
 2N2↑+Na2SO4+4H2O(2分)
2N2↑+Na2SO4+4H2O(2分) Mg3N2(2分)
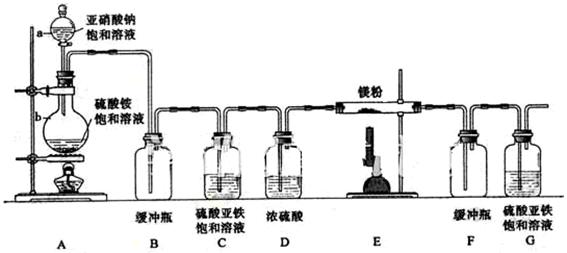
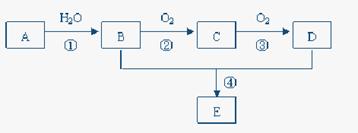
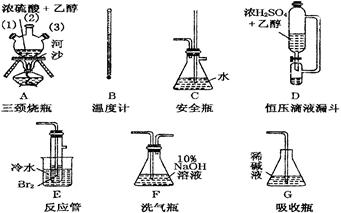
Mg3N2(2分) Mg3N2,从图看此反应在装置E中发生。由装置A及药品可知,A是N2的发生装置,其装置类型为:液+液
Mg3N2,从图看此反应在装置E中发生。由装置A及药品可知,A是N2的发生装置,其装置类型为:液+液 制气型;所以(1)中气密性检验方法是最常规的方法--微热法,其仪器名称:a是分液漏斗,b是圆底烧瓶;
制气型;所以(1)中气密性检验方法是最常规的方法--微热法,其仪器名称:a是分液漏斗,b是圆底烧瓶;

科目:高中化学 来源:不详 题型:单选题
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
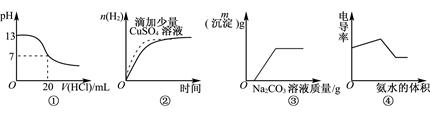
| A.图①表示25℃时,0.1mol·L-1盐酸滴定20mL 0.1mol·L-1NaOH溶液 |
| B.图②表示常温下,等量锌粉与足量的等体积等浓度的盐酸反应 |
| C.图③表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 |
| D.图④表示向盐酸和醋酸混合溶液中滴入氨水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
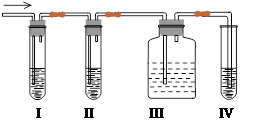
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
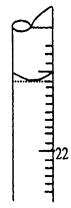
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| | 乙醇 | 1,2二溴乙烷 | 乙醚 |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com