将2.56g 铜粉与10mL浓硝酸反应,充分反应后收集到NO2和NO气体积为1.12L(标准状况下),测得溶液中剩余H+的物质的量浓度为1.0mol/L,试计算原浓硝酸的物质的量浓度(溶液体积变化忽略不计).
【答案】
分析:浓硝酸和铜反应生成硝酸铜和氮氧化物,溶液中剩余的氢离子来源于硝酸电离,根据氮原子守恒计算硝酸的物质的量,再根据物质的量浓度公式计算硝酸的浓度.
解答:解:铜的物质的量n(Cu)=
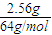
=0.04mol;
氮氧化物的物质的量n(气体)=
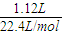
=0.05mol;
反应后溶液中硝酸的物质的量n(HNO
3)=1.0mol/L×0.01L=0.01mol,
依据氮原子守恒n(HNO
3)=2n[Cu(NO
3)
2]+n(气体)+n(HNO
3)
剩余=0.04mol×2+0.05mol+0.01mol=0.14mol,
则硝酸的物质的量浓度c(HNO
3)=
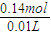
=14.0mol/L,
答:硝酸的物质的量浓度是14.0mol/L.
点评:本题考查了物质的量的有关计算,根据氮原子守恒计算生成的氮氧化物需要硝酸的物质的量,没必要计算出氮氧化物中各种气体的物质的量,很多同学易在此出错,难度中等.

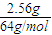 =0.04mol;
=0.04mol;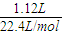 =0.05mol;
=0.05mol;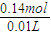 =14.0mol/L,
=14.0mol/L,

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案