
| A. | 单质熔点 Al>Mg>K>Na>Li | B. | 沸点 HI>HBr>HCl>HF | ||
| C. | 酸性 HClO4>H2SO4>H3PO4>H2SiO3 | D. | 稳定性 AsH3>PH3>NH3 |
分析 A.电荷越大,离子半径越小,对应金属单质的熔点越大;
B.HF分子间含氢键,沸点最高,其它氢化物的相对分子质量越大,沸点越大;
C.非金属性越强,对应最高价含氧酸的酸性越强;
D.非金属性越强,对应氢化物越稳定.
解答 解:A.电荷越大,离子半径越小,对应金属单质的熔点越大,则单质熔点 Al>Mg>Li>Na>K,故A错误;
B.HF分子间含氢键,沸点最高,其它氢化物的相对分子质量越大,沸点越大,则沸点 HF>HI>HBr>HCl,故B错误;
C.非金属性越强,对应最高价含氧酸的酸性越强,则酸性 HClO4>H2SO4>H3PO4>H2SiO3,故C正确;
D.非金属性越强,对应氢化物越稳定,则稳定性 AsH3<PH3<NH3,故D错误;
故选C.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
 .
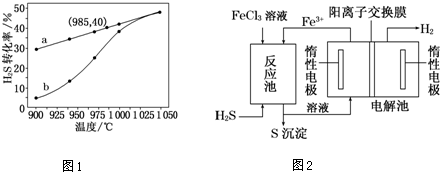
.
查看答案和解析>>
科目:高中化学 来源: 题型:推断题



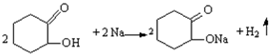 反应E→G的方程式为:HOOC(CH2)4COOH+2NaHCO3→NaOOC(CH2)4COONa+2CO2↑+2H2O.
反应E→G的方程式为:HOOC(CH2)4COOH+2NaHCO3→NaOOC(CH2)4COONa+2CO2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
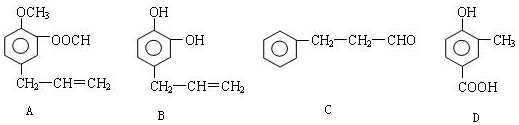
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b | B. | d1>d2 | C. | bω2≥aω1 | D. | a d1ω1=b d2ω2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散系的分类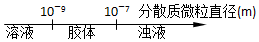 | |
| B. | Fe与Cl2反应的产物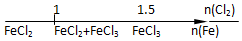 | |
| C. | 向AlCl3溶液滴加NaOH溶液后铝的存在形式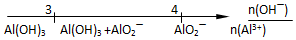 | |
| D. | Na与O2反应的产物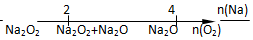 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液A和B均可以是盐酸或NaOH溶液 | |
| B. | 若溶液B选用浓H2SO4,反应条件需要加热,剩余固体为铝 | |
| C. | 溶液A和B均不可选用稀HNO3 | |
| D. | 实验室中方案Ⅱ更容易实施 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

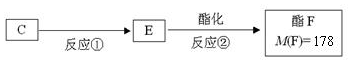
 .
. ,反应类型是酯化反应(或取代反应).
,反应类型是酯化反应(或取代反应). .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com