
绿色化学的最大特点在于它是在始端就采用实现污染预防的科学手段,因而过程和终端均为零排放或零污染。绿色化学主张在通过化学转换获取新物质的过程中充分利用每个原子,具有“原子经济性”,因此它既能够充分利用资源,又能够防止污染,下列化学反应,不符合绿色化学概念的是
A.消除硫酸厂尾气排放:SO2+NH3+H2O=(NH4)2SO3
B.消除制硝酸工业尾气的氮氧化物污染:NO2+NO+NaOH=2NaNO2+H2O
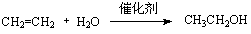 C.制CuSO4 :Cu+2H2SO4(浓)
C.制CuSO4 :Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D.工业制乙醇 :
科目:高中化学 来源: 题型:
石灰在工农业生产和建筑业有着重要用途。用于生产石灰的主要原料是石灰石(其主要成份为A),在石灰窑中加热焙烧石灰石得到B并放出气体C.生石灰在建筑业上主要用黏合剂,一般先使它“熟化”成D,D与沙子混合成“沙灰”用于砌筑砖墙。经过一段时间后,“沙灰”中的D又变成A.
(1)上述A、B、D三种物质所属的类别依次是
A.酸、碱、盐 B.碱、盐、氧化物
C.盐、碱性氧化物、酸性氧化物 D.盐、碱性氧化物、碱
(2)A→B+C的化学方程式为: ;
(3)新抹上 “沙灰”的墙易“出汗”(即有水滴附着在墙上),请用学过的化学知识解释这一现象:(写化学方程式) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族。C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍。试回答:
(1)写出下列元素的元素名称:A________,B________,C________,D________。
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是________。
(3)A与B形成的三原子分子的电子式是________,B与D形成的原子个数比为1∶1的化合物的电子式是________。
(4)A元素某氧化物与D元素某氧化物反应生成单质的化学方程式是
______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
矿泉水是人们居家旅游常用的饮料,市场上有些不法商贩为牟取暴利,用自来水(用氯气消毒)冒充矿泉水出售。为辨别真伪,可用下列的一种化学试剂来鉴别,该试剂是( )
A.酚酞试液 B.氯化钡溶液 C.氢氧化钠溶液 D.硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.1摩尔任何物质在标准状况下都是22.4升
B.同温同压下,相同体积气体所含原子个数相同
C.标准状况下1摩尔的水的体积约为22.4升
D.同温同压下,相同体积的H2、O2,其质量比为1︰16
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
A.乙烯、苯、溴苯分子中的所有原子均共平面
B.水加热至1000℃以上才分解是因为水分子间存在着氢键
C.常温下浓硫酸和浓硝酸能使铝发生钝化,所以可以用铝槽罐车运输浓硫酸、浓硝酸
D.能发生银镜反应的有机物结构中一定含有-CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
下列判断正确的是 ( )
①维生素C具有还原性,在人体内起抗氧化作用
②NO2溶于水时发生氧化还原反应
③1 mol Cl2参加反应转移电子数一定为2NA
④阴离子都只有还原性
⑤BaSO3和H2O2的反应为氧化还原反应
A.①②⑤ B.②③⑤ C.③④⑤ D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大。A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2—离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2。
请回答下列问题:
⑴A、B、C、D四种元素中,电负性最大的是 (填元素符号)。
⑵B的氢化物的沸点远高于A的氢化物的主要原因是 。
 ⑶由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为 。
⑶由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为 。
⑷E2+离子能与AC分子形成[E(AC)4]2+,其原因是AC分子中含有 。
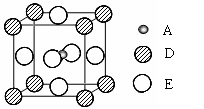
⑸最近发现,只含A、D、E三种元素的一种晶体(晶胞如右图所示)具有超导性。A原子的配位数为 ;该晶体的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com