
下列离子方程式书写正确的是
A.FeCl2溶液中通入氯气:Fe2++Cl2 = Fe3++2Cl-
B.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-= Ca CO3↓+H2O
C.FeS固体放入稀硝酸溶液中:FeS+2H+= Fe2++H2S↑
D.碳酸氢镁和足量的氢氧化钙溶液反应:Ca2++OH-+HCO3-=Ca CO3↓+H2O
科目:高中化学 来源:2014-2015学年湖南省衡阳市高二上学期期中考试化学试卷(解析版) 题型:填空题
(16分)Ⅰ、现有下列仪器或用品:①铁架台(含铁圈、各种铁夹);②锥形瓶;③滴定管(酸式与碱式);④烧杯(若干个);⑤玻璃棒;⑥天平(含砝码);⑦滤纸;⑧量筒;⑨三角漏斗。有下列药品:①NaOH固体;②0.1000mol/L的标准NaOH溶液;③未知浓度的盐酸;④Na2CO3溶液。试回答以下问题。
(1)做酸碱中和滴定时,还缺少的试剂是 (全对得分,下同)
(2)配制250mL0.1000mol/LNaOH溶液时,还缺少的仪器是 。
(3)过滤时,应选用上述仪器中的 (填编号)
Ⅱ、为测定某H2C2O4溶液的浓度,取25.00mL该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。滴定原理为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
(1)滴定时,KMnO4溶液应装在 (填“酸式滴定管”或“碱式滴定管” )中,达到滴定终点的现象为 。
(2)若滴定时,没用标准液洗涤滴定管,会使得草酸溶液的物质的量浓度_ _ (填“偏高”“偏低”“无影响”)
(3)若滴定时,反应前后的两次读数分别为a和b,则实验测得所配草酸溶液的物质的量浓度为 mol/L。
(4)在该溶液与KOH溶液反应所得的0.1 mol/L KHC2O4溶液中,c(C2O42-)>c(H2C2O4),下列关系正确的是 。
A. c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
B.c (HC2O4-)+ c (C2O42-)+ c(H2C2O4)=0.1mol/L
C. c(H+)<c(OH-)
D.c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下表各选项中,不能利用置换反应通过Y得到W的一组化合物是( )
选项化合物 | A | B | C | D |
Y | CO2 | Fe2O3 | SiO2 | FeCl3 |
W | MgO | Al2O3 | CO | CuCl2 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第一次月考化学试卷(解析版) 题型:填空题
(10分)下图是中学常见物质间的转化关系。已知:(a)A为淡黄色固体,B为导致“温室效应”的主要物质; (b)E为常见金属,J为红褐色沉淀;(c)G在实验室中常用于检验B的存在;(d)L是一种重要的工业原料,常用于制造炸药,浓溶液常呈黄色。
回答下列问题:
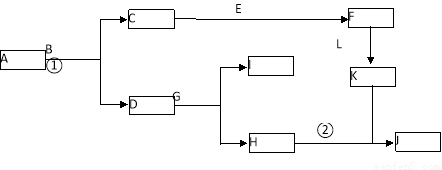
(1)A的电子式 。
(2)反应①的化学方程式为 ,反应②的离子方程式为
(3)若参加反应的A的质量为39g,则转移的电子数目为 。
(4)向含n g L的稀溶液中加入m g E,两者恰好完全反应,若L只被还原为+2价化合物,则n∶m不可能为 。
A.5∶1 B.9∶2 C.3∶1 D.4∶1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
将ag镁铝合金投入到x mL 2mol/L的盐酸中,金属完全溶解后,再加入y mL 1mol/L的氢氧化钠溶液,得到的沉淀量最大,质量为(a+1.7)g。下列说法不正确的是
A.镁铝合金与盐酸反应转移电子总数为0.1NA
B.x=2y
C.沉淀是Mg(OH)2和Al(OH)3的混合物
D.2x=y
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
将足量CO2通入下列各溶液中,所含离子还能大量共存的是
A.K+、SO32+、Cl-、NO3- B.H+、NH4+、Al3+、SO42-
C. Na+、S2-、OH-、SO42- D.Na+、C6H5O-、CH3COO-、HCO3-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧
瓶内的气体接触(如图),容器内的压强由大到小的顺序是
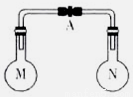
编号 | ① | ② | ③ | ④ |
气体M | H2S | H2 | N H3 | NO |
气体N | SO2 | Cl2 | HCl | O2 |
A.①②③④ B.②④①③ C.④①②③ D.①④③②
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省浏阳市高一上第一次月考试卷化学试卷(解析版) 题型:选择题
下列分散系最不稳定的是 ( )
A.向CuSO4溶液中加入Ba(OH)2溶液得到的分散系
B.向水中加入食盐得到的分散系
C.向沸水中滴入饱和FeCl3溶液得到的红褐色液体
D.向NaOH溶液中通入CO2得到的无色溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高一上学期第一次阶段考试化学试卷(解析版) 题型:填空题
实验室需要0.1 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
①如图所示的仪器中,配制溶液肯定不需要的是__________________________ (填序号),配制上述溶液还需用到的玻璃仪器有 (填仪器名称)。

②配制0.1 mol/L NaOH溶液时,其正确的操作顺序是(字母表示,每个字母只能用一次) 。
A.将容量瓶盖紧,振荡,摇匀
B.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
C.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
D.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
E.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
F.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
③配制0.1 mol/L NaOH溶液时,在实验中其他操作均正确,若定容时仰视容量瓶刻度线,则所配溶液浓度 0.1 mol/L(填“大于”、“等于”或“小于”)。
④配制0.5 mol/L硫酸溶液500 mL时,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为 mL(计算结果保留一位小数)。
⑤配制0.5 mol/L硫酸溶液时,在实验中其他操作均正确,若用量筒量取浓硫酸时仰视刻度线,则所配溶液浓度 0.5 mol/L(填“大于”、“等于”或“小于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com