
在t℃时,足量的![]() 饱和溶液中加入a
g无水碳酸钠,可析出m g碳酸钠晶体,则m-a的值是
饱和溶液中加入a
g无水碳酸钠,可析出m g碳酸钠晶体,则m-a的值是
[
]A
.饱和溶液失去水的质量 B.减少饱和溶液的质量C
.析出无水盐的质量 D.溶液中溶质减少的质量 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案科目:高中化学 来源: 题型:阅读理解
| ||
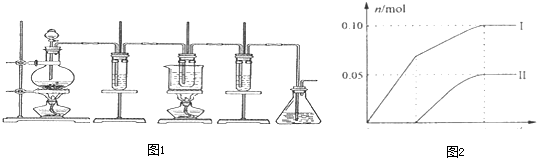
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
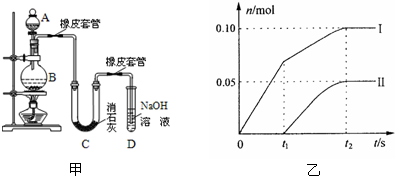
查看答案和解析>>
科目:高中化学 来源: 题型:
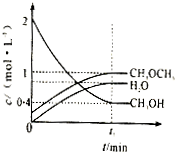 Ⅰ.(1)利用水煤气合成二甲醚(CH3OCH3)的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),△H=-274KJ/mol.该反应在一定条件下的密闭容器中达到平衡后,为同时提高反应速率和二甲醚的产率,可以采取的措施是
Ⅰ.(1)利用水煤气合成二甲醚(CH3OCH3)的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),△H=-274KJ/mol.该反应在一定条件下的密闭容器中达到平衡后,为同时提高反应速率和二甲醚的产率,可以采取的措施是查看答案和解析>>
科目:高中化学 来源:2010-2011学年江西省赣州市高三下学期十一县市期中联考(理综)化学部分 题型:选择题
下列说法正确的是( )
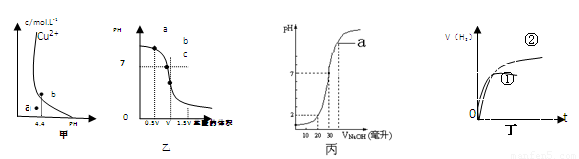
A、图甲表示某温度下,Cu(OH)2在溶液中达到沉淀溶解平衡后,改变溶液PH,Cu2+浓度的变化。由图可知点溶液未达到饱和,因此,点的Ksp[Cu(OH)2]小于b点。
B、图乙表示在室温时用一定浓度的盐酸滴定Vml同浓度的氨水。b点时溶液中C(NH4+)=C(Cl-),且溶液中水的电离程度最大。
C、图丙表示在室温时,用0.1mol/LNaOH溶液滴定30.00ml0.15mol/LCH3COOH溶液,点a所示溶液中C(Na+)>C(CH3COO-)>C(OH-)>C(H+)
D、图丁可表示同体积同PH的某一元强酸溶液①和某一元中强酸溶液②分别
与足量的锌粉发生反应生成V(H2)随时间(t)的变化情况。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A、图甲表示某温度下,Cu(OH)2在溶液中达到沉淀溶解平衡后,改变溶液PH,Cu2+浓度的变化。由图可知点溶液未达到饱和,因此,点的Ksp[Cu(OH)2]小于b点。
B、图乙表示在室温时用一定浓度的盐酸滴定Vml同浓度的氨水。b点时溶液中C(NH4+)=C(Cl-),且溶液中水的电离程度最大。
C、图丙表示在室温时,用0.1mol/LNaOH溶液滴定30.00ml0.15mol/LCH3COOH溶液,点a所示溶液中C(Na+)>C(CH3COO-)>C(OH-)>C(H+)
D、图丁可表示同体积同PH的某一元强酸溶液①和某一元中强酸溶液②分别
与足量的锌粉发生反应生成V(H2)随时间(t)的变化情况。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com