
��![]() ����ijЩ�����л���ʱ�����������HC1�����÷�ӦA����ʵ���ȵ�ѭ�����á���ӦA:
����ijЩ�����л���ʱ�����������HC1�����÷�ӦA����ʵ���ȵ�ѭ�����á���ӦA: ![]()
(1) ��֪:��ӦA�У� 4mol HCI���������ų�115.6kJ��������
��

![]() �ĵ���ʽ��_______________.
�ĵ���ʽ��_______________.
�ڷ�ӦA���Ȼ�ѧ����ʽ��_______________��
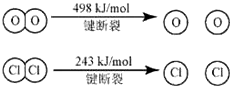
�۶Ͽ�1 mol H��O ����Ͽ� 1 mol H��Cl �������������ԼΪ__________KJ��![]() ��
��
H��O ����HCl��H��Cl�����ǿ����������_______________��
��2�����ڷ�ӦA����ͼ��4��Ͷ�ϱ�[n��HCl����![]() ���ֱ�Ϊ1��1��2��1��4��1��6��1��]�£���Ӧ�¶ȶ�HClƽ��ת����Ӱ������ߡ�
���ֱ�Ϊ1��1��2��1��4��1��6��1��]�£���Ӧ�¶ȶ�HClƽ��ת����Ӱ������ߡ�

������b��Ӧ��Ͷ�ϱ���______________.
�ڵ�����b, c, d��Ӧ��Ͷ�ϱȴﵽ��ͬ��HCIƽ��ת����ʱ����Ӧ�ķ�Ӧ�¶���Ͷ
�ϱȵĹ�ϵ��_________________.
��Ͷ�ϱ�Ϊ2:1���¶�Ϊ400��ʱ��ƽ��������![]() �����ʵ���������_______________.
�����ʵ���������_______________.

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| CuO/CuCl | 400�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��Cl2����ijЩ�����л���ʱ�����������HCl�����÷�ӦA����ʵ���ȵ�ѭ�����ã�400�棬���������£���ӦA��4HCl+O2�T2Cl2+2H2O
��Cl2����ijЩ�����л���ʱ�����������HCl�����÷�ӦA����ʵ���ȵ�ѭ�����ã�400�棬���������£���ӦA��4HCl+O2�T2Cl2+2H2O

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| CuO/CuCl3 | 400�� |



 2Cl2��g��+2H2O��g����H=-115.6 KJ/mol
2Cl2��g��+2H2O��g����H=-115.6 KJ/mol 2Cl2��g��+2H2O��g����H=-115.6 KJ/mol
2Cl2��g��+2H2O��g����H=-115.6 KJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| 400�� |
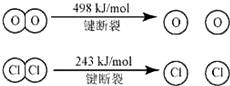
| A��16kJ | B��24kJ |
| C��32kJ | D��48kJ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com