
(6分)把10.2 g镁铝合金的粉末放入过量的盐酸中,得到11.2 L H2(标准状况下)。试计算:(原子量:Mg—24、Al—27)
(1)该合金中镁的质量分数。
(2)该合金中镁与铝的物质的量之比。
(3)该合金溶于足量的烧碱溶液中,产生H2的体积(标准状况下)是多少?
(1)47% (2)1:1 (3)6.72L
【解析】
试题分析:设合金中镁和铝的物质的量分别是xmol和ymol,则24x+27y=10.2,根据方程式可知
Mg+2HCl=MgCl2+H2↑ 2Al+6HCl=2AlCl3+3H2↑
1 1 2 3
x x y 1.5y
所以x+1.5y=11.2L÷22.4L/mol=0.5mol
解得x=y=0.2
(1)该合金中镁的质量分数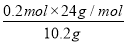 ×100%=47%。
×100%=47%。
(2)该合金中镁与铝的物质的量之比1:1。
(3)该合金溶于足量的烧碱溶液中,镁与烧碱不反应,只有铝与烧碱反应,在反应中铝仍然是失去3个电子,所以产生H2的体积(标准状况下)是0.3mol×22.4L/mol=6.72L。
考点:考查镁铝合金与酸碱反应的计算


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年贵州省高二上学期半期考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Fe2+、NO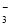 、SO
、SO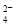 、Na+
、Na+
B.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO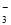
C.c(H+)/c(OH-)=1012的溶液中:NH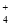 、Al3+、NO
、Al3+、NO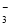 、Cl-
、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO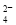 、SCN-
、SCN-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省四地六校高一上学期第一次月考化学试卷(解析版) 题型:选择题
关于NaOH溶液和Fe(OH)3胶体描述正确的是
A.两者的分散质都属于碱
B.两者均为有色不透明的分散系
C.两者分散质的直径都介于10-9~10- 7m之间
D.一束光线分别通过时,两者都会产生“丁达尔效应”
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省厦门市高一上学期期中考试化学试卷(解析版) 题型:选择题
已知常温下在溶液中可发生如下两个离子反应:Ce4++ Fe2+=Fe3++ Ce3+
Sn2++ 2Fe3+=2Fe2++ Sn4+,由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是
A. Sn2+、Fe2+、Ce3+ B. Sn2+、Ce3+、Fe2+
C. Ce3+、Fe2+、Sn2+ D. Fe2+、Sn2+、Ce3+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省厦门市高一上学期期中考试化学试卷(解析版) 题型:选择题
下列溶液中的c(Cl-)与50mL1mol/L氯化铝溶液中的c(Cl-)相等的是
A.150mL1mol/L氯化钠溶液 B.75mL2mol/L 氯化铵溶液
C.150mL1mol/L氯化钾溶液 D.75mL3mol/L氯化钾溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高一9月月考化学试卷(解析版) 题型:选择题
在标准状况下,1体积水溶解700体积氨气,所得溶液密度为0.9g/cm3,这种氨水的物质的量浓度和溶质的质量分数分别为
A.18.4mol·L-1 34.7% B.20.4mol·L-1 38.5%
C.18.4mol·L-1 38.5% D.20.4mol·L-1 34.7%
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高一9月月考化学试卷(解析版) 题型:选择题
设阿伏加德罗常数为6.02×1023 mol-1 。关于1mol H2O的叙述正确的是( )
A.含有1mol H2B.含有6.02×1023个水分子
C.质量为18 g/molD.在标准状况下的体积为22.4 L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省宝鸡市岐山县高一上学期期中质量检测化学试卷(解析版) 题型:选择题
某10% NaOH溶液,加热蒸发掉100 g水后得到80 mL 20%的溶液,则该20% NaOH溶液的物质的量浓度为
A.6.25 mol/L B.12.5 mol/L
C.7 mol/L D.7.5 mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高二上学期10月月考化学试卷(解析版) 题型:选择题
一定条件下,向某密闭容器中加入一定量的N2和H2发生可逆反应
N2(g)+3H2(g)  2NH3(g) ΔH = -92.2kJ?mol—1,测得0到10秒内,c(H2)减小了0.75mol?L—1,下列说法正确的是( )
2NH3(g) ΔH = -92.2kJ?mol—1,测得0到10秒内,c(H2)减小了0.75mol?L—1,下列说法正确的是( )
A.10到15秒内c(NH3) 增加量等于0.25mol ?L—1
B.10秒内氨气的平均反应速率为0.025mol?L—1?s—1
C.达平衡后,分离出少量NH3,v正增大
D.该反应的逆反应的活化能不小于92.2kJ?mol—1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com