
| 消耗量 |
| 起始量 |
| 0.75mol/L |
| 3mol/L |
| 0.75×0.75 |
| 0.25×2.25 |
| 2.5×2.5 |
| (a-2.5)×12.5 |
| x2 |
| (m-x)2 |
| x |
| 2x |


科目:高中化学 来源: 题型:
| A、酸性:H2SiO3<H2SO4<HClO4 |
| B、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C、稳定性:HCl>H2S>PH3 |
| D、还原性:F->Cl->Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
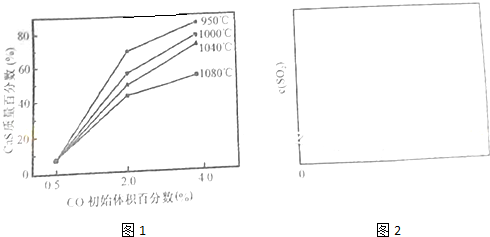
查看答案和解析>>
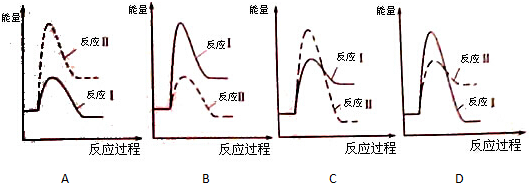
科目:高中化学 来源: 题型:

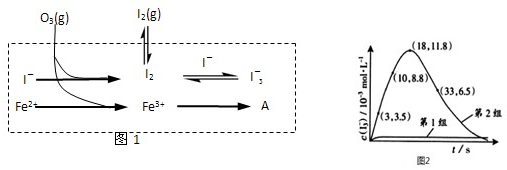
| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+I- | 5.2 | |
| 第2组 | O3+I-+Fe2+ | 5.2 | 4.1 |
| 开始沉淀pH | 完全沉淀pH | |
| Fe2+ | 7.6 | 9.6 |
| Fe3+ | 2.87 | 3.87 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 鉴别失去标签的氯化钡、碳酸钠和稀盐酸三种无色溶液.
鉴别失去标签的氯化钡、碳酸钠和稀盐酸三种无色溶液.查看答案和解析>>
科目:高中化学 来源: 题型:
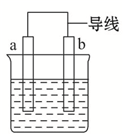 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用KOH溶液鉴别SO3(g)和SO2 |
| B、用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2 |
| C、用CO2鉴别NaAlO2溶液和CH3COONa溶液 |
| D、用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
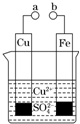 某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )| A、a和b用导线连接时,铁片上发生还原反应 |
| B、a和b不连接时,铁片上会有金属铜析出 |
| C、a和b用导线连接时,电流由a经导线流向b,溶液中SO42-流向Fe电极 |
| D、无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com