
| A. | X的常见氢化物水溶液显弱碱性 | |
| B. | 组成为HZO的物质结构式为H-Z-O | |
| C. | 最高价氧化物对应水化物酸性:Z>X>Y | |
| D. | 简单离子半径:Z>Y>X |
分析 短周期元素X、Y、Z的原子序数依次递增,X形成的常见含氧酸能氧化氢后金属,则X为N,X与Y、Z位于相邻周期,Y、Z应位于第三周期,且Y、Z原子最外层电子数之比为3:7,则Y为Al,Z为Cl,然后结合元素周期律来解答.
解答 解:短周期元素X、Y、Z的原子序数依次递增,X形成的常见含氧酸能氧化氢后金属,则X为N,X与Y、Z位于相邻周期,Y、Z应位于第三周期,且Y、Z原子最外层电子数之比为3:7,则Y为Al,Z为Cl,
A.X的常见氢化物为氨气,水溶液显弱碱性,故A正确;
B.组成为HZO的物质结构式为H-O-Z,故B错误;
C.非金属性Cl>N>Al,则最高价氧化物对应水化物酸性:Z>X>Y,故C正确;
D.电子层越多,离子半径越大,具有相同电子排布的离子原子序数大的离子半径小,则简单离子半径:Z>X>Y,故D错误;
故选AC.
点评 本题考查原子结构与元素周期律,为高频考点,把握X形成的常见含氧酸能氧化氢后金属推断X为N元素为解答的关键,侧重分析与推断能力的考查,注意周期律及元素化合物知识的应用,题目难度不大.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
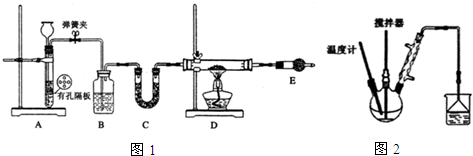
 芦笋中的天冬酰胺(结构如图1)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.
芦笋中的天冬酰胺(结构如图1)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.| 化学式 | 键长/nm | 键角 |
| H2O | 0.99 | 104.5° |
| H2S | 1.34 | 92.3° |
| H2Se | 1.47 | 91.0° |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z元素的含氧酸一定是强酸 | |
| B. | 原子半径:X>Z | |
| C. | 气态氢化物热稳定性:W>X | |
| D. | W、X与H形成化合物的水溶液可能呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +45 kJ/mol | B. | +32.7 kJ/mol | C. | -45 kJ/mol | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )的路线如下图所示:
)的路线如下图所示: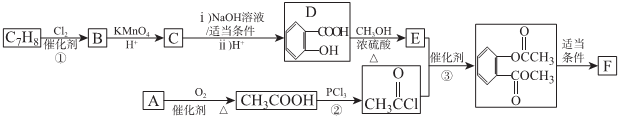
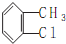 .
.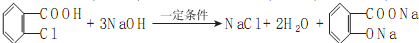 .
.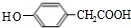 .
.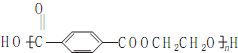 ),参照A→乙酸的表示方法,写出相应的合成路线图
),参照A→乙酸的表示方法,写出相应的合成路线图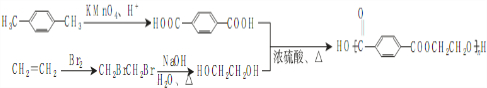 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
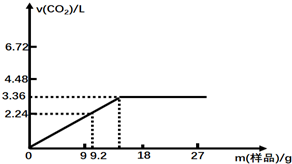
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
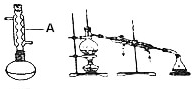 苯佐卡因(对氨基甲酸乙酯)常用于创面、溃疡面及痔疮的止痛,也是镇咳药退咳药的中间体,有关数据和实验装置图如下:
苯佐卡因(对氨基甲酸乙酯)常用于创面、溃疡面及痔疮的止痛,也是镇咳药退咳药的中间体,有关数据和实验装置图如下: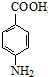 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$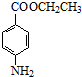 +H2O.
+H2O.| 相对分子质量 | 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | 水中溶解性 | |
| 乙醇 | 46 | 0.789 | -117.3 | 78.5 | 与水任意比互溶 |
| 对氨基苯甲酸 | 137 | 1.374 | 188 | 339.9 | 微溶于水 |
| 对氨基苯甲酸乙酯 | 165 | 1.039 | 90 | 172 | 难溶于水,易溶于醇、醛类 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com