
 50ml0.50mol•L-1������50mL0.55mol•L-1NaOH��Һ������ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ�����зų��������ɼ����к��ȣ��ش��������⣺
50ml0.50mol•L-1������50mL0.55mol•L-1NaOH��Һ������ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ�����зų��������ɼ����к��ȣ��ش��������⣺| ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶ȣ�t2���� | �²t2-t1���� | ||
| ���� | NaOH��Һ | ƽ��ֵ | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.0 | 3.0 |
| 2 | 25.1 | 25.1 | 25.1 | 28.2 | 3.1 |
| 3 | 25.1 | 25.1 | 25.1 | 28.3 | 3.2 |
���� ��1���������ȼƵĹ������жϸ�װ�õ�ȱ����������ͼ��ʾ����һ��������ɢʧ��
��2������Ũ����ϡ��ʱҪ�ų�����������
��3���ȸ���Q=m•c•��T���㷴Ӧ�ų���������Ȼ����ݡ�H=-$\frac{Q}{n}$kJ/mol�������Ӧ�ȣ�
��� �⣺��1�������ȼƵĹ����֪��װ�õ�ȱ�������Ǣٻ��β�����������Ӳֽ�壨�ǰ壩����ͼ��ʾ����һ��������ɢʧ����Ӧ������¶�ƫС����õ��к�����ֵ�����С��
�ʴ�Ϊ�����β���������Ӳֽ�壨�ǰ壩��ƫС��ƫС��
��2��Ũ����ϡ��ʱҪ�ų��������¶����ߣ�����Ӧ�ų�������ƫ�����õ��к��ȵ���ֵ��ƫ�ߣ�
�ʴ�Ϊ��ƫ�ߣ�����Ũ��������ˮ���ȣ�
��3��50ml0.50mol•L-1������50mL0.55mol•L-1NaOH��Һ�����кͷ�Ӧ������ˮ�����ʵ���Ϊ0.05L��0.50mol/L=0.025mol����Һ������Ϊ��100ml��1g/ml=100g���¶ȱ仯��ֵΪ����ʵ���ƽ��ֵ3.1�棬������0.025molˮ�ų�������ΪQ=m•c•��T=100g��4.18J/��g•�棩��3.1��=1295.8J����1.2958kJ������ʵ���õ��к��ȡ�H=-$\frac{1.2958kJ}{0.025mol}$=-51.832kJ/mol��
�ʴ�Ϊ��-51.832kJ/mol��
���� ���⿼���к��ȵIJⶨԭ������㣬��Ŀ�Ѷ��еȣ�ע�������к��ȵĸ�����ԭ���ǽ���Ĺؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2CH3CH2OH+2Na��2CH3CH2ONa+H2�� | |
| B�� | 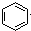 +HNO3$��_{��}^{Ũ����}$ +HNO3$��_{��}^{Ũ����}$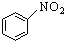 | |
| C�� | CH3CH=CH2+B2r��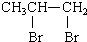 | |
| D�� | CH3COOH+CH3CH2OH$?_{��}^{Ũ����}$CH3COOCH2CH+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ��NH4Al��SO4��2��Һ�еμ��ռ���Һ | |
| B�� | 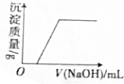 ��Ca��HCO3��2��Һ�еμ��ռ���Һ | |
| C�� | 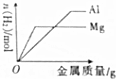 ��100mL1mol•L-1�����зֱ����������þ�ۺ����� | |
| D�� | 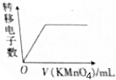 ��FeCl2��KI�Ļ����Һ�еμ�����KMnO4��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ѧ���ȴ���������ԭ��֮�䣬�ִ��������ڷ���֮�� | |
| B�� | �Ǽ��Լ�ֻ������˫ԭ�ӵĵ��ʷ����� | |
| C�� | ����ԭ��֮���ǿ����� | |
| D�� | ���ۼ�ֻ�ܴ����ڹ��ۻ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���

 CH3COOCH��CH3��2+H2O��ȡ����Ӧ��������Ӧ��Ӧ����
CH3COOCH��CH3��2+H2O��ȡ����Ӧ��������Ӧ��Ӧ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
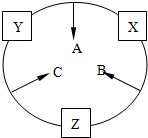 ԭ������֮��Ϊ16�����ֶ�����Ԫ��x��y��z��Ӧ�ĵ��� X��Y��Z�����³�ѹ�¾�Ϊ��ɫ���壬���ʵ������µ���X��Y��Z֮����Է�����ͼ��ʾ�ı仯����֪B���������zԭ�Ӹ�����C��������һ����
ԭ������֮��Ϊ16�����ֶ�����Ԫ��x��y��z��Ӧ�ĵ��� X��Y��Z�����³�ѹ�¾�Ϊ��ɫ���壬���ʵ������µ���X��Y��Z֮����Է�����ͼ��ʾ�ı仯����֪B���������zԭ�Ӹ�����C��������һ���� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com