
| A.1:9 | B.1:1 | C.2:9 | D.1:2 |
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源:不详 题型:单选题

| A.煤炭、石油、沼气 | B.水能、生物能、天然气 |
| C.太阳能、风能、潮汐能 | D.地热能、海洋能、核能 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氢气虽可由水制备获得,但水资源严重匮乏 |
| B.氢气制备耗能巨大,廉价制氢技术尚未成熟 |
| C.氢气贮存、运输等安全技术已经很好地解决了 |
| D.氢气燃烧产物虽无污染,但其放出热量较少 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a>b | B.a=10-4b | C.b=10-4a | D.a=b |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
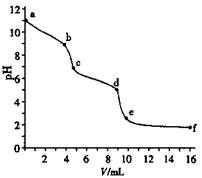
| A.该Na2CO3溶液的浓度为0.001 mol·L—1 |
| B.在pH ="6" 时,c(Na+)>c(HCO3—)>c(CO32—) |
| C.在pH ="7" 时,c(Na+)=c(Cl—) |
| D.c→d发生的主要离子反应:CO32—+H+=HCO3— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用蒸馏水冼净滴定管后,装入标准盐酸进行滴定 |
| B.用蒸馏水冼净锥形瓶后,再用NaOH液润洗,而后装入一定体积的NaOH溶液 |
| C.用甲基橙做指示剂,当溶液由黄色变成橙色,立刻读数盐酸体积。 |
| D.用碱式滴定管取10.00 mLNaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.混合溶液的pH等于7 | B.混合溶液的pH大于7 |
| C.加入酸碱的物质的量相等 | D.混合溶液还能再中和盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| CaSO4 | 9.1×10-6 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 废水浓度 | 29.4g/L | 1.6g·L-1 |
| 排放标准 | pH 6~9 | 0.5mg·L-1 |
 HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。
HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com