
2SO2(g)+O2(g)![]() 2SO3(g);ΔH=-98.3 kJ·mol-1
2SO3(g);ΔH=-98.3 kJ·mol-1
N2(g)+3H2(g)![]() 2NH3(g);ΔH=-46.2 kJ·mol-1
2NH3(g);ΔH=-46.2 kJ·mol-1
根据勒夏特列原理,加热均不利于产物的生成。试分析工业上为什么均采用加热到500 ℃的高温。
科目:高中化学 来源: 题型:
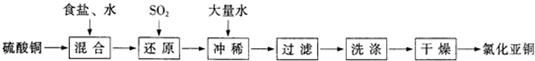
| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所x需时间/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
| 一定条件 |

查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组比较中,前者大于后者的是( )
A.中和体积与pH都相等的醋酸溶液和盐酸所消耗的NaOH的质量
B.软水和硬水中Ca2+、Mg2+的含量
C.硫酸工业中二氧化硫的催化氧化反应与合成氨生产中所采用的压强
D.相同温度、相同浓度的NH4Cl和NH4HSO4溶液中c(NH4+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com