
【题目】将铁片和碳棒按图所示方式插入硫酸铜溶液中,电流计指针发生偏转.下列针对该装罝的说法,正确的是( )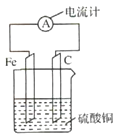
A.碳棒是正极
B.该装置能将电能转化为化学能
C.外电路中电流由铁片流出经过电流计流向碳棒
D.该装置的总反应为:2Fe+3Cu2+=2Fe3++3Cu
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】某工厂用含NH4+废水处理工业废气(其化学成分为CO2、SO2、NO,不考虑其他成分)的工艺流程如下:

(1)固体1的主要成分为Ca(OH)2、___________。
(2)气体2无毒性,写出处理含NH4+废水时所发生反应的离子方程式:_________________________。
(3)查阅资料可知:向2mol气体1中通入不同量的O2,并将所得混合气体通入NaOH溶液中,有关含氮组分的物质的量变化如图所示。

上述工艺流程中气体1与O2的体积比(相同条件)应控制为_____________________________。
(4)为测定上述流程中所得NaNO2溶液的物质的量浓度,准确量取10.00mLNaNO2溶液样品与24.00mL0.05mol/L过量的酸性KMnO4溶液充分反应,反应后所得溶液用0.1mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去,消耗(NH4)2Fe(SO4)2溶液10.00mL。
通过计算确定NaNO2溶液的物质的量浓度(写出计算过程)。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应,转化关系中有些反应的产物和反应的条件没有全部标出。
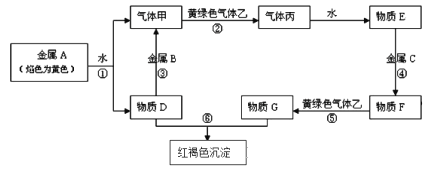
请根据以上信息回答下列问题:
(1)写出金属元素A在周期表中的位置:____________,物质D的电子式:____________。
(2)写出下列反应的离子方程式:反应③__________________________________;
反应⑤_______________________________________。
(3)检验物质G中阳离子的操作方法 ________________________________________。
(4)实验室制取黄绿色气体乙的化学方程式为 _________________________________,在该反应中如有0.5mol乙生成,转移电子的物质的量是______mol,制取完毕,多余的乙将用D的水溶液来吸收,其离子方程式为 ______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示与对应叙述相符的是

A. 图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)<Ksp(CuS)
B. 图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C. 该温度下向20mL0.1mol/LCH3COOH溶液中逐滴加入0.1mol/LNaOH溶液,pH变化曲线如图丙所示(忽略温度变化),则①点c(CH3COO-)>c(Na+)>c(CH3COOH)
D. 图丁表示反应N2(g)+3H2(g)![]() 2NH3(g)平衡时NH3体积分数随起始
2NH3(g)平衡时NH3体积分数随起始![]() 变化的曲线,则转化率:αA(H2)=αB(H2)
变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应属于加成反应的是( )
A.CH3CH3+Cl2 ![]() CH3CH2Cl+HCl
CH3CH2Cl+HCl
B.CH2═CH2+HBr→CH3CH2Br
C.2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.CH3COOH+CH3CH2OH ![]() H3COOCH2CH3+H2O
H3COOCH2CH3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钌(Ru)是一种硬而脆的多价稀有金属,性质很稳定。实验室用H2还原RuO2来制备金属钌的装置如图所示。下列说法不正确的是

A. 加热试管前,应先收集气体并点燃,通过爆鸣声判断气体的纯度
B. 洗气瓶中盛装的可能是NaOH 溶液,用于除去HCl
C. 结束反应时,先关闭活塞K,再停止加热
D. 启普发生器不可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性小组为了探究石蜡油分解产物,设计了如下实验方案。下列说法错误的是
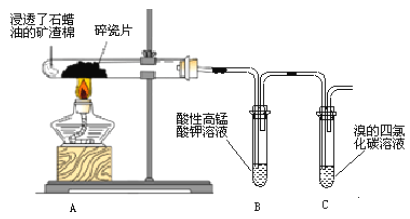
A. 碎瓷片有催化和积蓄热量的作用
B. 结束反应时,先撤出导管,再停止加热
C. 石蜡油是液态烷烃
D. B、C中溶液均褪色,反应类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.反应Fe+H2S04=FeS04+H2↑的能量变化趋势,如图所示:

(1)该反应为______反应(填“吸热”或“放热”)。
(2)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为______极(填“正”或“负”)。铜片上产生的现象为_____________,该极上发生的电极反应为____________,
II.在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g)=3C(g)+nD(g),开始时 A为4mol, B为6 mol, 5min末时测得C的物质的量为3mol,用D表示的化学反应速率![]() (D)为 0.2 mol/(Lmin).
(D)为 0.2 mol/(Lmin).
计算:
(1)5 min末A的物质的量浓度为_________。
(2)前5 min 内用B表示的化学反应速率![]() (B))为__________。
(B))为__________。
(3)化学方程式中n的值为_________。
(4)此反应在四种不同情况下的反应速率分别为:

其中反应速率最快的是________(填编号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com