


科目:高中化学 来源: 题型:
| A、铁和稀硝酸反应:Fe+2H+=H2↑+Fe2+ |
| B、向Na2CO3饱和溶液中通入过量CO2:2Na++CO32-+CO2+H2O=2NaHCO3↓ |
| C、NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO2↑+H2O |
| D、向偏铝酸钠溶液中通入过量二氧化碳:2AlO2-+CO2+2H2O=2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
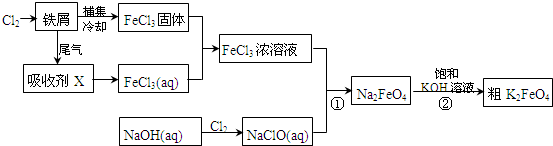
查看答案和解析>>
科目:高中化学 来源: 题型:
 1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8等.回答下列问题:
1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8等.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
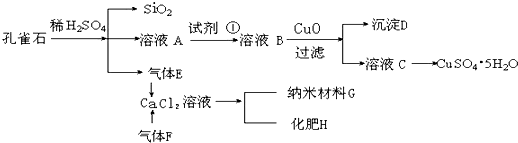
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe在常温下可与浓硝酸、稀硝酸、浓硫酸剧烈反应 |
| B、Al、Cl2均能和NaOH溶液发生氧化还原反应,且两单质的作用相同 |
| C、在稀硫酸中加入铜粉,铜粉不溶解,若再继续加入KNO3固体,铜粉会溶解 |
| D、金属单质Na、Mg、Fe在一定条件下与水反应都生成H2和相应的碱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com