

 (1分)
(1分)

科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.羟甲基(-CH2OH)和甲氧基(CH3O-) |
| B.亚硝酸(HNO2)和亚硝酸根(NO2-) |
| C.硝基(-NO2)和二氧化氮(NO2) |
| D.羟基(-OH)和氢氧根(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
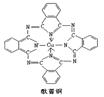
 其价电子排布式__________。第四周期中电子排布4s轨道上电子数与之相同的还有 元素(填元素符号)。
其价电子排布式__________。第四周期中电子排布4s轨道上电子数与之相同的还有 元素(填元素符号)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.T、R、U | B.T、U、R | C.U、R、T | D.U、T、R |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH4、NH3、H2 | B.OH-、F-、Ne |
| C.H3O+、NH4+、Na+ | D.O2-、F-、Mg2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
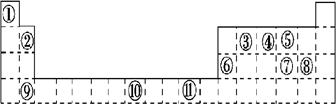
| | 第1列 | | ||||||
| 1 | ① | 第2列 | 第13列 | 第14列 | 第15列 | 第16列 | 第17列 | 第18列 |
| 2 | | | | ② | ③ | ④ | | ⑧ |
| 3 | ⑤ | | | | ⑥ | ⑦ | ⑨ | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com