
为了证明铜与稀硝酸反应产生的是NO,某校学生实验小组设计了一个实验,
其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,
内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的打气球。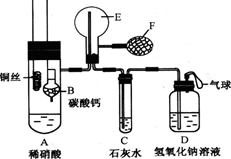
(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先除去其中的空气。其中第一步实验操作为: 。从装置的设计看,确定E中空气已被赶尽的实验现象是:______________。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为 。有人认为E中收集到的可能是H2而不是NO,如何证明? 。
(3)实验过程中,发现在未鼓入空气的情况下,E中就产生红棕色。有人认为是由装置E部分设计不当造成的。你认为装置应改进的地方是 。
(4)装置D的作用是 。
(1)将装CaCO3的干燥管下移与稀HNO3反应产生CO2;C处出现白色沉淀
(2)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O用F向E中鼓入空气,E内气体由无色变成棕色
(3)应左导管短,右导管长有利于排尽空气 (4)吸收多余的尾气,防止污染环境
解析试题分析:(1)要除去装置中残留的空气,可以利用碳酸钙和硝酸反应生成的CO2来实现,即将装CaCO3的干燥管下移与稀HNO3反应产生CO2;当装置中空气被排尽后,C中的澄清石灰水会变混浊,据此可以判断E中空气已被赶尽。
(2)硝酸是氧化性酸,和铜反应的离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。由于NO极易被氧化生成红棕色的NO2,据此可以证明。即操作是用F向E中鼓入空气,E内气体由无色变成棕色
(3)在未鼓入空气的情况下,E中就产生红棕色,这说明E中空气没有完全被排尽。由于CO2的密度大于空气的,因此正确的设计应该是左导管短,右导管长,这样才有利于排尽空气。
(4)NO、NO2等都是大气污染物,氢氧化钠溶液的主要是吸收多余的尾气,防止污染环境。
考点:考查稀硝酸和铜反应的实验探究的判断
点评:该题是中等难度的试题,也是高考中的常见题型。在注重对硝酸基础知识巩固和训练的同时,侧重对学生能力的培养。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
 Ⅰ.铜与稀硝酸反应的离子方程式为
Ⅰ.铜与稀硝酸反应的离子方程式为查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
Ⅰ.(4分)铜与稀硝酸反应的离子方程式为________________;在做铜与稀硝酸反应的实验时,常观察到试管内生成的气体先为浅红棕色,其原因是________________;为了能直接观察到生成的气体的颜色,可在往稀硝酸中加入铜的同时,加入少量碳酸盐,那么加入少量碳酸盐的作用是________________。
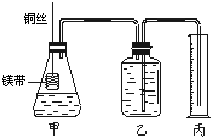
Ⅱ.某研究性学习小组欲证明:在同温同压下,相同浓度、相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如下图。该实验的主要操作步骤如下:

①配制浓度均为1 mol?L-1盐酸和醋酸溶液;
②量取15.00 mL 1 mol?L-1盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端;
④在广口瓶中装足量的水,按图连接好装置,检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录相关数据;
⑥反应结束后待温度恢复到室温,调整乙和丙中液面使二者处于同一平面,读出量筒中水的体积为V mL。
请你参与实验并回答下列问题:
(1)量取15.00 mL 1 mol?L-1盐酸和醋酸溶液所用的仪器是 ;
A.带刻度的烧杯 B.量筒 C.酸式滴定管 D.碱式滴定管
(2)步骤③中a的数值至少是 ;步骤④中检查该装置气密性的操作与观察方法是:____________________;步骤⑤中应记录的数据是 ;
(3)本实验装置丙中量筒的规格是 (填序号)。
A.10mL B.100 mL C.200 mL D.500 mL
(4) 若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:Vm=____;
(5)试简述速率不等的原因是_________;铜丝不与酸接触的原因是_______________。
(6)试写出镁与醋酸溶液反应的离子方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com