
恒温下,在容积为1升的甲、乙两个恒容密闭容器中分别充入H2和I2发生可逆
H2(g) +I2(g) 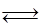 2HI(g) ΔH =" -14.9" kJ/mol,实验时有关数据如下表:
2HI(g) ΔH =" -14.9" kJ/mol,实验时有关数据如下表: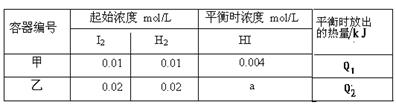
下列判断正确的
| A.平衡时,乙中颜色更深,a>0.008 |
| B.平衡时,放出的热量:Q1=1/2Q2 =0.149kJ |
| C.该温度下,该反应的平衡常数K="4" |
| D.平衡后,向甲中再冲入0.004 mol HI气体,再次达到平衡时HI的百分含量不变 |
D
解析试题分析:A、乙容器的反应物浓度是甲容器反应物浓度的2倍,该反应是反应前后气体物质的量不变的可逆反应,所以恒温恒容时,压强的改变对该反应无影响,因此达平衡时乙容器的HI的浓度是甲容器HI的2倍,颜色加深但a=0.008,错误;B、可逆反应的反应物不会完全转化,所以平衡时,放出的热量:Q1=1/2Q2<0.149kJ,错误;C、该温度下,该反应的平衡常数K=0.0042/0.001×0.001=16,错误;D、平衡后,向甲中再冲入0.004 mol HI气体,相当于又增加了0.002mol的H2、I2,其物质的量比与开始时相同都为1:1,所以再达平衡时与原平衡等效,HI的百分含量不变,正确,答案选D。
考点:考查同一可逆反应不同条件的平衡的比较,等效平衡的判断


科目:高中化学 来源: 题型:单选题
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO +3HSO
+3HSO ===3SO
===3SO +Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快。上图为用ClO
+Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快。上图为用ClO 在单位时间内的物质的量浓度的变化来表示该反应的速率一时间图象。下列说法不正确的是( )
在单位时间内的物质的量浓度的变化来表示该反应的速率一时间图象。下列说法不正确的是( )
| A.反应开始时速率增大可能是c(H+)增大引起的 |
| B.纵坐标为v(H+)的速率—时间曲线与图中曲线能完全重合 |
| C.后期反应速率下降的主要原因是反应物的浓度减小 |
| D.图中的阴影部分“面积”为t1~t2时间内ClO的物质的量浓度的减小值 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于化学反应限度的叙述中正确的是( )
| A.化学反应的限度都相同 |
| B.可以通过改变反应条件控制化学反应的限度 |
| C.可以通过延长化学反应的时间改变化学反应限度 |
| D.当一个化学反应在一定条件下达到限度时反应即停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在盛有足量M的体积可变的密闭容器中加入N,发生反应:M (s) +2N (g)==4P (s) +Q (g) ΔH< 0。在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的变化关系如图所示。下列说法正确的是
| A.平衡是N的转化率为50% |
| B.当温度升高后,则图中θ>450 |
| C.若再加入N,则正、逆反应速率均逐渐增大 |
| D.若再加入N,则反应体系中气体密度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
可逆反应A(g)+3B(g) 2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
A.v(A)=0.15mol/(L·min) B.v (B)=0.6 mol/(L·min)
C.v (C)=0.3 mol/(L·min) D.v (D)=0.1 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
镁条和盐酸反应迅速产生大量的氢气,欲使反应速率减慢,可采取的措施有:
①降温;②把镁条粉碎;③加入蒸馏水使盐酸变稀;④升温
| A.①② | B.②③ | C.①③ | D.②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列图示与对应的叙述相符的是
A.根据图①可判断可逆反应A2(g)+3B2(g) 2AB3(g)的ΔH>0 2AB3(g)的ΔH>0 |
B.图②表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(g)的影响,乙的压强大 3C(g)+D(g)的影响,乙的压强大 |
| C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
| D.据图④,若除去0.1mol·L-1CuSO4溶液中混有的Fe3+,可向溶液中加入适量NaOH至pH约为7 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法错误的是
A.对于A(s)+2B(g)  3C(g) ΔH>0,若平衡时C的百分含量跟条件X、Y的关系如图①所示,则Y可能表示温度,X可能表示压强,且Y3>Y2>Y1
3C(g) ΔH>0,若平衡时C的百分含量跟条件X、Y的关系如图①所示,则Y可能表示温度,X可能表示压强,且Y3>Y2>Y1
B.已知可逆反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始物质的量相同,则图②可表示温度对NO的百分含量的影响
4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始物质的量相同,则图②可表示温度对NO的百分含量的影响
C.已知反应2A(g)  B(?)+2C(?)-Q(Q>0),满足如图③所示的关系,则B、C可能均为气体
B(?)+2C(?)-Q(Q>0),满足如图③所示的关系,则B、C可能均为气体
D.图④是恒温下某化学反应的反应速率随反应时间变化的示意图,则该反应的正反应是一个气体体积增大的反应
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
碘单质难溶于水却易溶于KI溶液。碘水中加入KI溶液发生反应:I2(aq)+I-(aq)  I(aq),该反应的平衡常数与温度的关系如图,下列说法不正确的是( )
I(aq),该反应的平衡常数与温度的关系如图,下列说法不正确的是( )
| A.上述正反应为放热反应 |
| B.上述体系中加入苯,平衡不移动 |
| C.可运用该反应原理除去硫粉中少量的碘单质 |
| D.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com