
【题目】下列离子方程式中,正确的是( )
A.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
B.氧化亚铁与稀盐酸混合:FeO+2H+=Fe3++H2O
C.氯化铝与过量氨水反应:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D.氢氧化钡溶液与稀硫酸H2SO4反应:Ba2++SO42-=BaSO4↓
科目:高中化学 来源: 题型:
【题目】下列图示与对应叙述相符的是
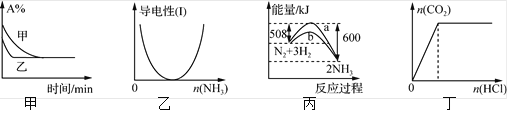
A. 图甲表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
B. 图乙表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
C. 图丙表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂
D. 图丁表示一定浓度Na2CO3溶液中滴加盐酸,生成CO2与滴加盐酸物质的量的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )
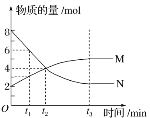
A. 化学方程式:2M![]() N
N
B. t2时,正逆反应速率相等,达到平衡
C. t3时,正反应速率大于逆反应速率
D. t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 硅酸钠溶液与盐酸的反应:Na2SiO3+2H+===H2SiO3↓+2Na+
B. 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O===3I2+6OH-
C. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
D. 向NaHCO3溶液中滴加少量Ba(OH)2溶液:Ba2++OH-+HCO3—===BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切联系.下列有关说法正确的是( )
A.目前研究菠菜蛋白质“发电”不属于“太阳能文明”
B.二氧化硫有毒,禁止用作葡萄酒添加剂
C.燃料电池是利用燃料在电池中燃烧实现热能转化为电能
D.太阳能电池可将太阳能直接转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱的原料,也是一种常用的制冷剂。
(1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L 的密闭容器内充入1mol N2和3mol H2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
反应时间 /min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25 min 时,以N2 表示的平均反应速率=__________。
(2)工业合成氨的反应方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH,下图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图2是合成氨反应在2L 容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) ΔH,下图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图2是合成氨反应在2L 容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。


下列说法正确的是________________。
A.ΔH=-92.4kJ/mol
B.使用催化剂会使E1的数值增大
C.为了提高转化率,工业生产中反应的浓度越低越好
D.图II是不同温度下反应体系中氨的物质的量与反应时间关系图,且TA>TB;
E.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为![]() mol·L-1·min-1
mol·L-1·min-1
(3)一定温度下,向一个容积为2 L的密闭容器中通入2 mol N2和7 mol H2,达到平衡时测得容器的压强为起始时的![]() 倍,在同一温度,同一容器中,将起始物质改为amol N2 ,b molH2,c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
倍,在同一温度,同一容器中,将起始物质改为amol N2 ,b molH2,c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
(二)在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为________molL-1s-1

(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020molL-1s-1的平均速率降低,经10s又达到平衡。T_______100℃(填“大于”“小于”),判断理由是________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向_______(填“正反应”或“逆反应”)方向移动,判断理由是__________________。
(4)已知:
甲醇脱水反应2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应2CH3OH(g)=C2H4 (g)+2H2O(g) △H2=-29.1kJ·mol-1
乙醇异构化反应CH3CH2OH(g)=CH3OCH3(g)) △H3=+50.7kJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H=____________ kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应A(g)+3B(s) ![]() C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A. v(A)=2 mol·L-1·min-1 B. v(B)=1.2 mol·L-1·s-1
C. v(C)=0.1 mol·L-1·s-1 D. v(D)=0.4 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)。下列能说明反应达到平衡状态的是
SO3(g)+NO(g)。下列能说明反应达到平衡状态的是
A. 体系的压强保持不变
B. 混合气体的密度保持不变
C. 混合气体的颜色保持不变
D. 每消耗1molSO3的同时生成1molNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】查阅资料知:Br2的沸点为58.8 ℃,密度为3.119 g·cm-3,微溶于水,有毒。
Ⅰ.(1)常温下,单质溴通常呈________态,保存时通常在盛溴的试剂瓶中加入少量________。
Ⅱ.工业生产中,海水提取溴常用热空气吹出法。其生产流程如下:

某化学实验小组模拟该法设计了如下实验装置(夹持装置略去)从浓缩的海水中提取液溴。实验步骤如下:
①关闭活塞b、d,打开活塞a、c,向A中缓慢通入Cl2至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③关闭b,打开a,再通过A向B中通入足量的Cl2;
④将B中所得液体进行蒸馏,收集液溴。

(2)当观察到A中液面上方出现________(实验现象)时即可判断步骤①中反应已经结束。
(3)X试剂可以是________(填字母,下同),尾气处理选用________。
a.H2O b.饱和食盐水 c.氢氧化钠溶液 d.饱和Na2SO3溶液
B中X试剂发生反应的离子方程式为________________________________。
(4)蒸馏时应该选择______(填序号),操作中应控制的关键实验条件为____________。

Ⅲ.该实验小组利用制得的单质溴研究H2与Br2生成HBr的反应,实验装置如下:

(5)E装置可用来检验反应产物HBr,则D装置的作用是_______。若要检验E中收集的HBr,图示装置检验HBr还不够完善,请结合原有实验装置予以改进:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com