
 ③
③ ⑤
⑤ .
. 分析 (1)活泼金属和活泼非金属元素之间易形成离子键,铵根离子和酸根离子之间存在离子键;非金属元素之间易形成共价键;
(2)氯化铵中铵根离子和氯离子之间存在离子键、N-H原子之间存在共价键,过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在共价键,二氧化碳分子中C-O原子之间只存在共价键.
解答 解:(1)活泼金属和活泼非金属元素之间易形成离子键,铵根离子和酸根离子之间存在离子键;非金属元素之间易形成共价键,所以仅含有离子键的有②⑥,仅含有共价键的有④⑤,含有离子键和共价键的有①③,
故答案为:②⑥;④⑤;①③;
(2)氯化铵中铵根离子和氯离子之间存在离子键、N-H原子之间存在共价键,过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在共价键,二氧化碳分子中C-O原子之间只存在共价键,所以其电子式分别为 、
、 、
、 ,故答案为:
,故答案为: ;
; ;
; .
.
点评 本题考查化学键判断及电子式的书写,为高频考点,明确离子键和共价键概念及区别、电子式书写规则是解本题关键,注意氯化铵中存在的化学键,不能根据是否含有金属元素判断离子键,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 全部正确 | B. | 只有①⑤正确 | ||
| C. | 只有③正确 | D. | 以上说法都是错误的 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
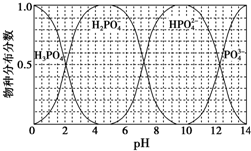 磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示.
磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅥA族元素的原子半径越大,越容易得到电子 | |
| B. | I A族与VIIA族元素间能形成离子化合物也能形成共价化合物 | |
| C. | I A族元素的金属性比ⅡA族元素的金属性强 | |
| D. | 原子最外层电子数为2的元素一定位于元素周期表中的ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应开始时的速率:甲<乙 | |
| B. | 反应开始时,酸的物质的量浓度:甲>乙 | |
| C. | 反应开始时,酸的物质的量浓度:甲<乙 | |
| D. | 反应所需时间:甲<乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH≡CH | B. | CH2=CH2 | C. | CH2=C(CH3)CH3 | D. | CH≡C-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
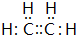 B的结构简式
B的结构简式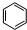 .
. ,反应类型:取代反应.
,反应类型:取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
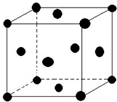 请根据如表相关信息,回答问题.
请根据如表相关信息,回答问题.| A | 基态原子最外层电子数是次外层的三倍 |
| B | 基态原子核外有13种不同运动状态的电子 |
| C | 与B同一周期,原子中未成对电子数是同周期中最多 |
| D | D2-的核外电子排布与氩原子相同 |
| E | 是ds区原子序数最小的元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com