
分析 (1)锌与稀盐酸反应生成氯化锌与氢气,据此书写反应离子方程式,计算氢气的体积;
(2)根据方程式,结合c=$\frac{n}{V}$计算氯化锌的物质的量浓度.
解答 解:(1)2.6克锌的物质的量为$\frac{2.6g}{65g/mol}$=0.04mol,HCl的物质的量为0.06L×1mol/L=0.06mol,
Zn+2H+═Zn2++H2↑
1mol 2mol 1mol 22.4L
0.04mol 0.06mol VL
则锌过量,按照盐酸计算,所以V=0.03mol×22.4L/mol=0.672L
故答案为:0.672L;
(2)由方程式可知氯化锌的物质的量为:n(氯化锌)=n(氢气)=0.03mol,所以氯化锌物质的量浓度为:$\frac{0.03mol}{0.06L}$=0.5mol/L,
故答案为:0.5mol/L.
点评 本题考查根据方程式进行的计算,题目难度不大,注意把握过量计算的方法,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:解答题
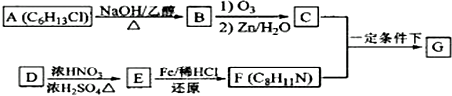


 +HO-NO2$→_{△}^{浓H_{2}SO_{4}}$
+HO-NO2$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O. .
. (写出其中一种的结构简式).
(写出其中一种的结构简式).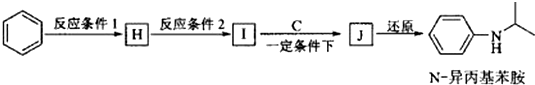
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2SO2(g)+O2(g)$?_{500℃}^{V_{2}O_{5}}$2SO3(g)△H=-196.6kJ/mol,若2molSO2完全反应则放出热量等于196.6kJ | |
| B. | “冰,水为之,而寒于水”说明相同质量的水和冰比较,冰的能量高 | |
| C. | 已知C(石墨)=C(金刚石)△H=+1.9kJ/mol,则从能量角度看金刚石比石墨稳定 | |
| D. | 氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 操作 | |
| A | 观察钠与水反应的现象 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 检验NaHCO3与Na2CO3溶液 | 用小试管分别取少量溶液,然后滴加澄清石灰水 |
| C | 证明Na2O2与CO2是放热反应 | Na2O2用棉花包裹,放入充满CO2的集气瓶中,棉花燃烧说明是放热反应 |
| D | 检验Na2CO3与K2CO3溶液 | 用稀硫酸清洗过的铂丝分别蘸取溶液,在酒精灯外焰上灼烧,透过蓝色钴玻璃观察火焰的颜色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80% | B. | 85% | C. | 90% | D. | 95% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com