

分析 由流程可知,溶解后调节pH除去少量杂质Fe3+,过滤后蒸发结晶得到Na2Cr2O7,然后加入KCl发生Na2Cr2O7+2KCl═K2Cr2O7+2NaCl,加热沸腾,加快反应进行,结合溶解度图可知,低温下K2Cr2O7的溶解度较小,则冷却结晶得到K2Cr2O7,母液II蒸发浓缩只有析出NaCl(A),母液Ⅲ冷却结晶主要得到K2Cr2O7(B),以此来解答.
解答 解:由流程可知,溶解后调节pH除去少量杂质Fe3+,过滤后蒸发结晶得到Na2Cr2O7,然后加入KCl发生Na2Cr2O7+2KCl═K2Cr2O7+2NaCl,加热沸腾,加快反应进行,结合溶解度图可知,低温下K2Cr2O7的溶解度较小,则冷却结晶得到K2Cr2O7,母液II蒸发浓缩只有析出NaCl(A),母液Ⅲ冷却结晶主要得到K2Cr2O7,
(1)由Na2Cr2O7生产K2Cr2O7的化学方程式为Na2Cr2O7+2KCl═K2Cr2O7+2NaCl,由溶解度图可知,低温下K2Cr2O7的溶解度远小于其它组分,随温度的降低,K2Cr2O7的溶解度明显减小,则可通过冷却结晶析出大量K2Cr2O7晶体,
故答案为:Na2Cr2O7+2KCl═K2Cr2O7+2NaCl;低温下K2Cr2O7的溶解度远小于其它组分,随温度的降低,K2Cr2O7的溶解度明显减小;
(2)母液中含少量杂质Fe3+,向Na2Cr2O7母液中加碱液调pH的目的是除去Fe3+,
故答案为:除去Fe3+;
(3)由上述分析可知,A为NaCl,B为K2Cr2O7,
故答案为:NaCl;K2Cr2O7;
(4)向母液Ⅰ中加入KCl时,加热沸腾的原因是增大接触面积加快反应速率,
故答案为:增大接触面积加快反应速率;
(5)用热水洗涤固体A为氯化钠,氯化钠能溶于水,所以洗涤液中有一定量的氯化钠,所以将回收洗涤液转移到母液Ⅱ中,可以提高原料的使用率,
故答案为:提高原料的使用率.
点评 本题考查了无机物制备流程,把握生产重铬酸钾的实验流程及溶解度的利用为解答的关键,注重分析能力、实验能力及知识综合应用能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在地壳中的含量:Fe>Al>Na | |
| B. | 均能与盐酸反应,生成物中金属价态数值:Al>Fe>Na | |
| C. | 钠、铝均能从FeCl3溶液中置换出铁 | |
| D. | 等质量的三种金属与足量盐酸反应时,钠置换出的氢气最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 500℃时,在催化剂存在条件下,分别将2mol SO2和1mol O2置于恒压容器I和恒容容器II中(两容器起始容积相同),充分反应,二者均达到平衡后:
500℃时,在催化剂存在条件下,分别将2mol SO2和1mol O2置于恒压容器I和恒容容器II中(两容器起始容积相同),充分反应,二者均达到平衡后:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH4 | CH3-CH3 | CH2═CH2 |
| 物质的量分数 | 20% | 30% | 50% |
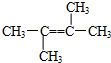 所示,
所示,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4晶体中阳离子和阴离子 | B. | Na2O2晶体中阴离子和阳离子 | ||
| C. | Mg2+离子中的质子和中子 | D. | 氯化钠中的质子总数和电子总数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com