
不能说明元素X的电负性比元素Y的大的是 ( )
| A.与H2化合时X单质比Y单质容易 |
| B.X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 |
| C.X原子的最外层电子数比Y原子的最外层电子数多 |
| D.X单质可以把Y从其氢化物中置换出来 |
科目:高中化学 来源: 题型:单选题
R为短周期元素,其原子所具有的电子层数为最外层电子数的1/2,它可能形成的常见含氧酸根离子有:
①R2O42-、②RO42-、③R2O32-、④RO32-。下列判断正确是
| A.若它能形成①时,则不可能形成②,③ |
| B.若它能形成②时,则还可以形成③,④ |
| C.若它能形成①时,则不可能形成④ |
| D.若它能形成②时,则可以形成① |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列所述变化规律正确的是
| A.Na、Mg、Al还原性依次增强 |
| B.HCl、PH3、H2S稳定性依次减弱 |
| C.NaOH、KOH、CsOH碱性依次增强 |
| D.S2-、Cl-、K+、Ca2+离子半径依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知A、B、C、D为短周期主族元素,其相对位置关系如图。C与B可形成离子化合物C3B2。下列分析正确的是 ( )。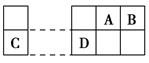
A.电负性:C>A
B.离子氧化性:C>D
C.氢化物稳定性:A>B
D.原子半径:r(C)>r(B)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
不具有放射性的同位素称为稳定同位素,稳定同位素分析法近20年来在植物生理学、生态学和环境科学研究中获得广泛应用。如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用作环境分析指示物。下列有关说法正确的是 ( )。
A.34S原子核内中子数为16
B.1H216O和1H218O的相对分子质量不同
C.13C和15N原子核内的质子数相差2
D.2H+结合OH-的能力比1H+的更强
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
A元素的阳离子与B元素的阴离子具有相同的电子层结构,关于两元素有以下叙述:①原子半径A<B;②离子半径A>B;③原子序数A>B;④原子最外层电子数A<B;⑤A的正化合价与B的负化合价的绝对值一定相等。其中正确的是 ( )
| A.①② | B.③④ | C.③⑤ | D.③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
元素周期律产生的根本原因就是随着元素原子序数的递增
| A.元素的相对原子质量逐渐增大 |
| B.核外电子排布呈周期性变化 |
| C.原子半径呈周期性变化 |
| D.元素主要化合价呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
各电子层排布电子的总数遵循以下规则:①每层最多容纳2n2个电子;②原子最外层电子数≤8;③原子次外层电子数≤18。决定这3条规律的电子排布规则是( )。
| A.能量最低原则 |
| B.泡利不相容原理 |
| C.洪特规则 |
| D.能量最低原则和泡利不相容原理 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com