
| A. | 在含有大量AlO2-的溶液中:Fe3+、Na+、NO3-、Cl- | |
| B. | 使淀粉碘化钾试纸变蓝的溶液中:K+、S2-、Cl-、HCO3- | |
| C. | 滴入KSCN溶液显红色的溶液中:K+、Fe2+、SO42-、Cl- | |
| D. | 与金属铝反应只能放出氢气的溶液中:NH4+、Cl-、Na+、NO3- |
分析 A.离子之间相互促进水解;
B.使淀粉碘化钾试纸变蓝的溶液,具有氧化性;
C.滴入KSCN溶液显红色的溶液,含铁离子;
D.与金属铝反应只能放出氢气的溶液,为非氧化性酸或强碱溶液.
解答 解:A.AlO2-与Fe3+能够相互促进水解生成沉淀,不能共存,故A错误;
B.使淀粉碘化钾试纸变蓝的溶液可以具有强氧化性,能将S2-氧化,不能共存,故B错误;
C.滴入KSCN溶液显红色的溶液中含有Fe3+,离子之间不反应,可大量共存,故C正确;
D.与金属铝反应只能放出氢气的溶液中可以是碱性溶液,则NH4+不能存在,且酸溶液中Al、NO3-发生氧化还原反应不生成氢气,故D错误;
故选C.
点评 本题考查离子反应及离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、水解反应、氧化还原反应的离子共存考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
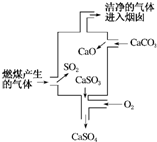
| A. | 使用此装置处理过的废气就不会对大气造成污染了 | |
| B. | 装置内发生的反应有化合、分解、置换和氧化还原反应 | |
| C. | 整个过程的反应可表示为2SO2+2CaCO3+O2═2CaSO4+2CO2 | |
| D. | 可用澄清的石灰水检验经过处理的废气是否达标 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 我国高速列车制造技术具有世界领先水平.高速列车制造要使用轻质金属材料.下列可
我国高速列车制造技术具有世界领先水平.高速列车制造要使用轻质金属材料.下列可| A. | 铝合金 | B. | 铜合金 | C. | 碳纤维 | D. | 硅纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中投入铁粉物质的量是0.25 mol | |
| B. | 原溶液中HNO3的浓度是2.0 mol•L-1 | |
| C. | 反应后的溶液中还可溶解9.6 g铜 | |
| D. | 反应后的溶液中c(Fe2+):c(Fe3+)=1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,下列可以验证C与D两元素原子得电子能力强弱的事实是BCD(填编号).
,下列可以验证C与D两元素原子得电子能力强弱的事实是BCD(填编号).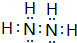 ;C的另一种氢化物与D的一种氢化物的电子总数相等,实验室制取C的该气态氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
;C的另一种氢化物与D的一种氢化物的电子总数相等,实验室制取C的该气态氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| W | X | Y | Z | |
| 结构 或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的碱性太弱 | B. | Al3+不与氨水反应 | ||
| C. | 生成的Al(OH)3溶解了 | D. | Al3+几乎都与F-结合生成了新物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com