
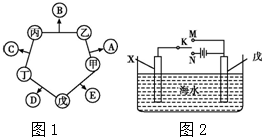
 甲、乙、丙、丁、戊五种单质在一定条件下反应生成A、B、C、D、E五种化合物,其转化关系如图1所示.又知:①甲、乙、丙、丁均为前三周期元素的单质,常温下均为气态,丙、丁是空气的主要成分,戊是应用最广泛的金属.②乙在甲中
甲、乙、丙、丁、戊五种单质在一定条件下反应生成A、B、C、D、E五种化合物,其转化关系如图1所示.又知:①甲、乙、丙、丁均为前三周期元素的单质,常温下均为气态,丙、丁是空气的主要成分,戊是应用最广泛的金属.②乙在甲中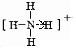 .
.分析 ①甲、乙、丙、丁均为前三周期元素的单质,常温下均为气态,丙、丁是空气的主要成分为O2和N2,C为NO,戊是应用最广泛的金属为Fe,
②乙在甲中燃烧发出苍白色火焰,E的水溶液呈黄色,判断甲为Cl2,乙为H2,A为HCl,E为FeCl3,丁为O2,D为铁的氧化物,丙为N2,B为NH3,
(1)A为HCl,B为NH3,反应生成氯化铵,阳离子为铵根离子,氮原子和四个氢原子形成共价键,铵根离子结构中氮原子和氢原子间的配位键是氮原子提供孤对电子,箭头指向氢;
(2)A为HCl,B为NH3,NH3分子间形成氢键;
(3)E的水溶液可使KI淀粉溶液变蓝是氯化铁氧化碘化钾生成碘单质;
(4)工业上可由B与丁反应制取C,是氨气的催化氧化生成一氧化氮和水;
(5)将甲和E同时加(通)入强碱性溶液中,可制得一种高效杀菌、净水剂,其中含由+6价戊元素形成的带2个单位负电荷的含氧酸根离子是高铁酸盐,反应
(6)作原电池正极或作电解池阴极的金属被保护.
解答 解:①甲、乙、丙、丁均为前三周期元素的单质,常温下均为气态,丙、丁是空气的主要成分为O2和N2,C为NO,戊是应用最广泛的金属为Fe,
②乙在甲中燃烧发出苍白色火焰,E的水溶液呈黄色,判断甲为Cl2,乙为H2,A为HCl,E为FeCl3,丁为O2,D为铁的氧化物,丙为N2,B为NH3,
(1)铵根离子结构中氮原子和氢原子间的配位键是氮原子提供孤对电子,箭头指向氢,结构式为: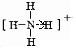 ,故答案为:
,故答案为: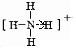 ;
;
(2)A为HCl,B为NH3,NH3分子间形成氢键沸点高,A与B的沸点比较,较高的是NH3,
故答案为:NH3;
(3)E的水溶液可使KI淀粉溶液变蓝是氯化铁氧化碘化钾生成碘单质,反应的离子方程式为:2Fe3++2I-=2Fe2++I2 ,
故答案为:2Fe3++2I-=2Fe2++I2 ;
(4)B是氨气,丁是氧气,在催化剂加热条件下,氨气被催化氧化生成一氧化氮和水,反应方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(5)E是氯化铁,净水剂中含由+6价Fe元素形成的带2个单位负电荷的含氧酸根离子,给离子的电荷及铁、氧元素的化合价知,该离子为FeO42-,该反应中铁元素失电子则氯元素得电子生成氯离子,所以离子反应方程式为2Fe3++3Cl2+16OH-=2FeO42-+6Cl-+8H2O,
故答案为:2Fe3++3Cl2+16OH-=2FeO42-+6Cl-+8H2O;
(6)作原电池正极或作电解池阴极的金属被保护,若X为碳棒,为减缓铁的腐蚀,则铁应作电解池阴极,所以开关K应该置于处N处;
若X为锌,开关K置于M处,该装置构成原电池,锌易失电子作负极,铁作正极而被保护,该电化学防护法称为牺牲阳极的阴极保护法,
故答案为:N;牺牲阳极的阴极保护法.
点评 本题考查了无机物的推断、原电池原理、氧化还原反应等,同时考查学生综合运用知识的能力,正确推断物质是解本题关键,根据物质的颜色、反应现象等题眼结合物质之间的转化关系来推断,难点是离子方程式的书写,题目难度中等.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
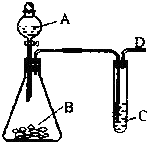 某同学用如图所示的装置来探究SO2的性质及有关实验.
某同学用如图所示的装置来探究SO2的性质及有关实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
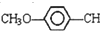 =CHCOOCH2CH2CH(CH3)2合成路线如下:
=CHCOOCH2CH2CH(CH3)2合成路线如下: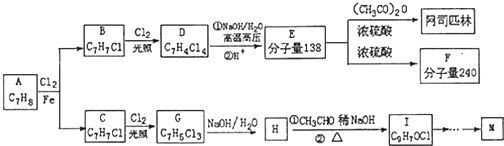
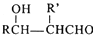 $\stackrel{△}{→}$RCH═
$\stackrel{△}{→}$RCH═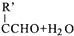
 ,H→I两步反应的反应类型加成反应、消去反应
,H→I两步反应的反应类型加成反应、消去反应
 任意1种.
任意1种.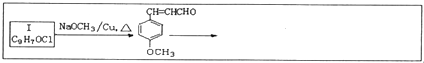
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ②③⑤ | C. | ①②⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| 0.01mol/LKIO3酸性溶液 (含淀粉)的体积/mL | 0.01mol/L Na2SO3溶液 的体积/mL | H2O 的体积 /mL | 实验温 度/℃ | 溶液出现 蓝色时所 需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 1:7 | C. | 1:6 | D. | 5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:7 | B. | 7:2 | C. | 2:1 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com