
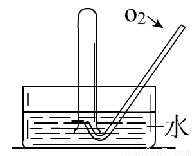
如图所示,将一瓶充满NO2气体的试管倒扣在水槽中,气体颜色由____逐渐变为____色,试管内的液面会逐渐_____________;当反应停止后向试管中缓慢通入氧气,气体颜色又由______色逐渐变为______色,之后又变为______色,试管内的液面会____________。用化学方程式表示试管中发生的化学反应_____________,____________。
科目:高中化学 来源:2016-2017学年河北省邯郸市高二下学期开学考试化学试卷(解析版) 题型:选择题
某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,下列对于该溶液的叙述不正确的是
A. 该温度高于25℃
B. 由水电离出来的H+的浓度是1.0×10-12 mol·L-1
C. 加入NaHSO4晶体抑制了水的电离
D. c(H+)=c(OH-)+ c(SO42-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省嘉峪关市高二上学期期末考试化学试卷(解析版) 题型:简答题
已知在25℃时,Ksp[Mg(OH)2]=3.2×10-11,Ksp[Cu(OH)2]=2.0×10-20
(1)在25℃时,向0.02mol/L的MgCl2溶液中加入NaOH固体,如果生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小为______mol/L;
(2)在25℃时,向浓度均为0.02mol/L的MgCl2和CuCl2混合溶液中逐滴加入NaOH溶液,先生成______沉淀(填化学式);生成该沉淀的离子方程式为_______;当两种沉淀共存时,c(Mg2+)/c(Cu2+)=________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省嘉峪关市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列说法中有明显错误的是( )
A. 对有气体参加的化学反应,增大压强体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大
B. 升高温度,一般可使活化分子的百分数增大,因而反应速率增大
C. 有效碰撞一定在活化分子之间,活化分子之间发生的碰撞一定为有效碰撞
D. 加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省嘉峪关市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列关于电解质溶液的叙述正确的是( )
A. 常温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大
B. 常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH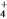 )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
C. 中和pH与体积均相同的盐酸和醋酸,消耗NaOH的物质的量相同
D. 将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省嘉峪关市高一上学期期末考试化学试卷(解析版) 题型:选择题
焰色反应是:( )
A. 单质的性质 B. 化合物的性质 C. 元素的性质 D. 离子的性质
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省嘉峪关市高一上学期期末考试化学试卷(解析版) 题型:选择题
在反应Cl2+2NaOH =NaCl +NaClO+H2O的变化中,当产生58.5gNaCl时,转移电子总数是:( )
A. 1.204×1024个 B. 6.02×1023个 C. 4.816×1023个 D. 2.408×1023个
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省新余市高二下学期入学考试化学试卷(解析版) 题型:实验题
绿矾(FeSO4 • 7H2O)是治疗缺铁性贫血的特效药.下面是以商品级纯度铁屑(含少量锡等杂质)生产绿矾的一种方法:

已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH 为3.0,沉淀完全时的pH为5.5:
回答下列问题:
(1)操作Ⅱ中用硫酸酸化至pH=2且通入硫化氢至饱和的目的是:
①除去操作I所得溶液中含有的Sn2+等杂质离子;
②____________________________;
③____________________________。
(2)操作IV的顺序依次为:_______________、_______________、过滤、洗涤。
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;②___________________。
(4)测定绿矾产品中Fe2+ 含量的方法是:a.称取8.680g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.02000 mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为30.00 mL(滴定时发生反应的离子方程式为:5Fe2+ + MnO4- + 8H+ ═ 5Fe3+ + Mn2+ + 4H2O)
①计算上述样品中FeSO4 • 7H2O的质量分数为_________________(结果保留4位有效数字,FeSO4 • 7H2O的摩尔质量为 278g/mol)
②若用上述方法测定的样品中FeSO4•7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有:样品中存在少量的杂质、___________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高二2月月考化学试卷(解析版) 题型:选择题
为了测定中和反应的反应热,计算时至少需要的数据是( )
①酸的浓度和体积 ②碱的浓度和体积 ③比热容④反应后溶液的质量
⑤生成水的物质的量 ⑥反应前后溶液温度变化 ⑦操作所需的时间
A. ①②③⑥ B. ①③④⑥ C. ③④⑤⑥ D. 全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com