
短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z分别位于同一主族,W与X可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍.下列叙述中不正确的是( )
|
| A. | WZ2分子中所有原子最外层都为8电子结构 |
|
| B. | WX2、ZX2的化学键类型相同 |
|
| C. | WX2是以极性键结合成的直线型分子 |
|
| D. | 原子半径大小顺序 W<X<Y<Z |
考点:
原子结构与元素周期律的关系.
专题:
元素周期律与元素周期表专题.
分析:
短周期元家W、X、Y、Z 的原子序数依次增大,Y原子的内层电子总数是其最外层电子数的2.5 倍,则Y有3个电子层,最外层电子数为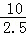 =4,即Y为Si,W与Y位于同一主族,所以W为C;W 与X可形成共价化合物WX2,则X为O,X与Z 位于同一主族,所以Z为S,然后利用元素及其单质、化合物的性质来解答.
=4,即Y为Si,W与Y位于同一主族,所以W为C;W 与X可形成共价化合物WX2,则X为O,X与Z 位于同一主族,所以Z为S,然后利用元素及其单质、化合物的性质来解答.
解答:
解:短周期元家W、X、Y、Z 的原子序数依次增大,Y原子的内层电子总数是其最外层电子数的2.5 倍,则Y有3个电子层,最外层电子数为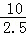 =4,即Y为Si,W与Y位于同一主族,所以W为C;W 与X可形成共价化合物WX2,则X为O,X与Z 位于同一主族,所以Z为S,
=4,即Y为Si,W与Y位于同一主族,所以W为C;W 与X可形成共价化合物WX2,则X为O,X与Z 位于同一主族,所以Z为S,
A.C原子最外层4个电子,O原子最外层6个电子,则CO2分子中所有原子最外层都为8电子结构,故A正确;
B.CO2、SO2的构成微粒都是分子,都属于分子晶体,且都只含有共价键,故B正确;
C.CO2分子中含有C﹣O极性键,结构对称,正负电荷的中心重合,属于直线形非极性分子,故C正确;
D.电子层越多,半径越大,同周期从左向右原子半径在减小,则原子半径为Y>Z>W>X,故D错误;
故选D.
点评:
本题考查位置、结构、性质,为高频考点,侧重于学生的分析能力的考查,注意把握元素的原子结构特点,熟悉元素及其化合物的性质即可解答,题目难度不大.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
下列各组物质分类正确的是( )
| A | B | C | D | |
| 强电解质 | HF | HClO4 | Ba(OH)2 | 食盐水 |
| 弱电解质 | Cu(OH)2 | NH3•H2O | CaCO3 | HClO |
| 非电解质 | Cu | SO2 | 蔗糖 | H2O |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
木糖醇常用做口香糖的甜味剂.木糖醇的结构简式为CH2OH﹣CHOH﹣CHOH﹣CHOH﹣CH2OH,下列有关木糖醇的说法不正确的是( )
|
| A. | 是一种单糖 | B. | 能发生酯化反应 |
|
| C. | 不能发生水解反应 | D. | 在口腔中不易被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有四种短周期元素,它们的结构、性质等信息如下表所述.
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)A原子的核外电子排布式 .
(2)B元素在周期表中的位置 ;离子半径:B A(填“大于”或“小于”).
(3)C原子的价电子排布图是 ,其原子核外有 个未成对电子,能量最高的电子为 轨道上的电子,其轨道呈 形.C的气态氢化物极易溶于水的原因是 ;与C的单质互为等电子体的分子的结构式 .
(4)D﹣的结构示意图是 .
(5)B的最高价氧化物对应的水化物与D的最高价氧化物的水化物反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式与所述事实相符且正确的是( )
|
| A. | 用硫氰化钾溶液检验溶液中的Fe3+:Fe3++3SCN﹣=Fe(SCN)3↓ |
|
| B. | 钢铁生锈的负极电极反应:Fe﹣3e﹣=Fe3+ |
|
| C. | 证明氯气氧化性大于硫可用:Cl2+S2﹣=2Cl﹣+S↓ |
|
| D. | 用钠与硫酸铜溶液反应证明金属性钠更强:2Na+Cu2+=Cu+2Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )

|
| A. | 原子半径:Z>Y>X |
|
| B. | 气态氢化物的稳定性:R>W |
|
| C. | WX3和水反应形成的化合物是离子化合物 |
|
| D. | Y和Z两者最高价氧化物对应的水化物不能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
氨气是一种重要的物质,可用于制取化肥和硝酸等.
(1)500°C、50Mpa时,在容积为VL的密闭容器中加入n mol N2、3n mol H2,经过t min后反应达到平衡后N2的转化率为a.则容器内气体的压强反应前与平衡时的比值为 ;t min内用NH3表示的速率是 ) mol/L.min
(2)工业合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g)+92.2kJ/mol
2NH3(g)+92.2kJ/mol
(表示当生成2mol NH3时放出92.2KJ的热).有关键能:N≡N:945.6kJ/mol;N﹣H:391.0kJ/mol,则H﹣H键能为 KJ/mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是( )
|
| A. | 用金属钠可区分乙醇和乙醚 |
|
| B. | 用高锰酸钾酸性溶液可区分己烷和3﹣己烯 |
|
| C. | 用水可区分苯和溴苯 |
|
| D. | 用新制的银氨溶液可区分甲酸甲酯和乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列判断正确的是 ( )
① 阴离子都只有还原性 ② NO2溶于水时发生氧化还原反应
③ 1 mol Cl2参加反应转移电子数一定为2NA ④ BaSO3和H2O2的反应为氧化还原反应
A.②④ B.②③ C.③④ D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com