
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源:不详 题型:单选题
 Zn+Ag2O+H2O
Zn+Ag2O+H2O| A.充电时,Ag极接电源的负极 |
| B.充电时,溶液中阴离子向阴极移动 |
C.放电时,负极反应为Zn+ 2OH―-2e-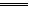 Zn(OH)2 Zn(OH)2 |
| D.放电时,当电路上有0.02 mol电子通过时,消耗负极材料2.32 g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.增大阴极碳钢网面积 |
| B.提高饱和氯化钠溶液的温度 |
| C.加大阴极与阳极间的距离 |
| D.提高电解时的电源电压 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | NaOH的质量分数 | 阴极析出的物质的质量/g | 阳极析出的物质的质量/g |
| A | 0.062 | 19 | 152 |
| B | 0.062 | 152 | 19 |
| C | 0.042 | 1.2 | 9.4 |
| D | 0.042 | 9.4 | 1.2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 R—R + H2↑+ 2CO2+ 2KOH(R—代表烃基)。关于无机产物,下列说法正确的是( )
R—R + H2↑+ 2CO2+ 2KOH(R—代表烃基)。关于无机产物,下列说法正确的是( )| A.含氢元素的产物均在阳极区上产生 | B.含氢元素的产物均在阴极区上产生 |
| C.含碳元素的产物均在阳极区上产生 | D.含碳元素的产物均在阴极区上产生 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电解过程产生的气体体积(在标准状况下)为5.6L | ||||
| B.电解过程转移的电子数为3.612×1023个 | ||||
| C.加入碱式碳酸铜的反应是:Cu2(OH)2CO3+2H2SO4═2CuSO4+CO2↑+3H2O | ||||
D.电解过程只发生了2CuSO4+2H2O
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com