
第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。继续失去第二个电子所需能量称第二电离能。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。回答下列问题:
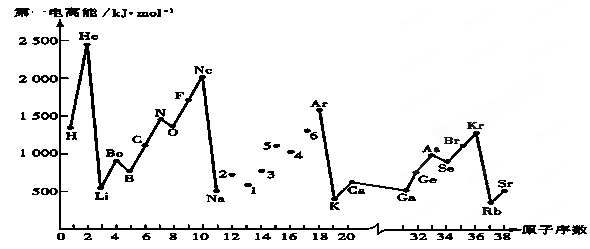
(1)同一周期元素的第一电离能从左到右总趋势是 (填增大、减小或不变,下同);同一主族元素原子从上到下的第一电离能I1变化规律是______________;稀有气体的第一电离能在同周期中是最大的,原因是______________________________________________________________________。
(2)认真分析上图中同周期元素第一电离能的变化规律,发现有一些反常,第一电离能 IIA>IIIA,VA>VIA: 如I1(铍)>I1(硼),2号大于1号,I1(氮)>I1(氧),5号大于4号。可能原因是 。(3)已知2号的I1=738KJ/mol, 则它的I2 738KJ/mol, I3 3×738KJ/mol;(填>、<、=)(4)已知5号和6号元素的电负性分别为2.1和3.0,则4号元素的电负性可能为( )
A.3.5 B.1.8 C.2.5 D.4.0
(5)上图中4、5、6三种元素最高价含氧酸的酸性从强到弱顺序为 _________ (用对应酸的化学式表示);它们的气态氢化物的稳定性均比同主族上一周期的元素气态氢化物弱,原因是: ______ 。
(每空1分,共9分)(1)增大;减小;已达稳定结构,不易失去电子
(2)第ⅡA族元素原子的ns轨道上电子排布达到全充满,第ⅤA族的p轨道半充满,是较稳定结构,难失去电子。而ⅢA族原子价电子排成ns2np1,若失去p能级的一个电子使剩余ns上达到全充满的较稳定结构,故I1较小 (3)>;> (4)C
(5)HClO4>H2SO4>H3PO4;上一周期的元素的氢化物分别为NH3、H2O、HF,半径小,键长小,键能大,分子稳定
【解析】
试题分析:(1)第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量,因此金属性越强第一电离能越小。同周期自左向右金属性逐渐减弱,非金属性逐渐增强,所以同一周期元素的第一电离能从左到右总趋势是增大;同主族自上而下金属性逐渐增强,非金属性逐渐减弱,则同一主族元素原子从上到下的第一电离能I1变化规律是逐渐减小;由于稀有气体元素的最外层电子已达稳定结构,不易失去电子,所以稀有气体的第一电离能在同周期中是最大。
(2)由于第ⅡA族元素原子的ns轨道上电子排布达到全充满状态,第ⅤA族的p轨道电子处于半充满状态,是较稳定结构,难失去电子。而ⅢA族原子价电子排成ns2np1,因此若失去p能级的一个电子使剩余ns上达到全充满的较稳定结构,故I1较小。
(3)由于镁元素的3s能级处于全充满状态,稳定性强,因此镁的第一电离能强于钠的,则2号元素是Mg。由于Mg失去最外层1个电子后使3s能级电子处于半充满状态,稳定性强,因此如果Mg元素的的I1=738KJ/mol,则它的I2>738KJ/mol。同样分析可知如果镁失去3s能级的2个电子后使2p能级的电子处于全充满状态,稳定性强,因此I3>3×738KJ/mol;
(4)由于P元素的3p能级处于半充满状态,稳定性强,因此P元素的第一电离能强于S元素的第一电离能,所以5、4、6三种元素分别是P、S、Cl。由于非金属性越强,电负性越大,所以S元素的电负性介于P和Cl元素之间,故答案选C。
(5)根据(OH)mROn可知n值越大,含氧酸的酸性越强,所以酸性强弱顺序是HClO4>H2SO4>H3PO4。由于上一周期的元素的氢化物分别为NH3、H2O、HF,半径小,键长小,键能大,分子稳定,因此它们的气态氢化物的稳定性均比同主族上一周期的元素气态氢化物弱。
考点:考查电离能、电负性、含氧酸酸性以及氢化物稳定性判断


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量.如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失).
第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量.如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失).查看答案和解析>>
科目:高中化学 来源: 题型:
| H | He | ||||||
| 1.3120 | 0.3723 | ||||||
| Li | Be | B | C | N | O | F | Ne |
| 0.5203 | 0.8995 | 0.8001 | 1.0864 | 1.4023 | 1.3140 | 1.6810 | 2.0807 |
| Na | Mg | Al | Si | P | S | Cl | Ar |
| 0.4958 | 0.7377 | 0.5776 | 0.7865 | 1.0118 | 0.9996 | 1.2511 | 1.5205 |
| K | Ca | Ga | Ge | As | Se | Br | Kr |
| 0.4189 | 0.5898 | 0.5788 | x | 0.9440 | 0.9409 | 1.1399 | 1.3507 |
| Rb | Sr | In | Sn | Sb | Te | I | Xe |
| 0.4030 | 0.5495 | 0.5583 | 0.7086 | 0.8316 | 0.8693 | 1.0084 | 1.1704 |
| Cs | Ba | Tl | Pb | Bi | Po | At | |
 主族元素
主族元素 )最近的C(用 表示)的位置.
)最近的C(用 表示)的位置.查看答案和解析>>
科目:高中化学 来源: 题型:
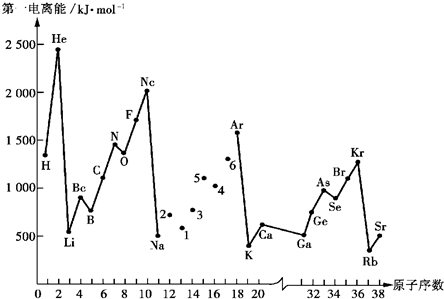
(12分)第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。
请回答以下问题:
⑴认真分析上图中同周期元素第一电离能的变化规律,将Na——Ar之间六种元素用短线连接起来,构成完整的图像。
⑵从上图分析可知,同一主族元素原子的第一电离能I1变化规律是____________;
⑶上图中5号元素在周期表中的位置是__________________________;
⑷上图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:_________________________________________________。
(5)同周期内,随原子序数增大,I1值增大。但个别元素的I1值出现反常现试预测下列关系式中正确的是__________。
①E(砷)>E(硒) ②E(砷)<E(硒) ③E(溴)>E(硒) ④E(溴)<E(硒)
(6)用氢键表示式写出HF溶液中存在的所有氢键_________________________________
查看答案和解析>>
科目:高中化学 来源:2014届吉林省高二下学期第一次月考化学试卷(解析版) 题型:填空题
(10分)第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
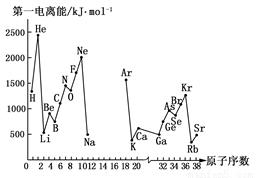
请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小(最小)范围为________<Al<________(填元素符号)。
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是________。
(3)上图中第一电离能最小的元素在周期表中的位置是________。
(4)根据对角线规则,Be、Al元素最高氧化物的水化物性质相似,它们都具有________,
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com