
���� Xԭ�Ӻ����M����ֻ�����ԳɶԵ��ӣ���������Ų�ӦΪ1s22s22p63s23p4��ΪSԪ�أ�Yԭ�Ӻ����L���������K���������Y��2�����Ӳ㣬����������Ϊ4����YΪCԪ�أ�Z�ǵؿ��ں�����ߵ�Ԫ�أ�ΪOԪ�أ�Q�ĺ˵������X��Z�ĺ˵����֮�ͣ�ԭ������Ϊ24��ΪCrԪ�أ�E��Ԫ�����ڱ��ĸ�Ԫ���е縺�����ӦΪFԪ�أ����Ԫ�ض�Ӧ���ʡ�������Ľṹ�����ʽ����⣮
��� �⣺Xԭ�Ӻ����M����ֻ�����ԳɶԵ��ӣ���������Ų�ӦΪ1s22s22p63s23p4��ΪSԪ�أ�Yԭ�Ӻ����L���������K���������Y��2�����Ӳ㣬����������Ϊ4����YΪCԪ�أ�Z�ǵؿ��ں�����ߵ�Ԫ�أ�ΪOԪ�أ�Q�ĺ˵������X��Z�ĺ˵����֮�ͣ�ԭ������Ϊ24��ΪCrԪ�أ�E��Ԫ�����ڱ��ĸ�Ԫ���е縺�����ӦΪFԪ�أ���
��1�������Ϸ�����֪��XΪS��YΪC��
�ʴ�Ϊ��S��C��
��2��QΪCr��ԭ������Ϊ24��λ�����ڱ��������ڢ�B�壬��������Ų�ʽΪ1s22s22p63s23p63d54s1������ϼ�Ϊ+6�ۣ�
�ʴ�Ϊ��Cr���ģ�1s22s22p63s23p63d54s1��+6��
���� ���⿼λ�á��ṹ�����ʹ�ϵ���ۺ�Ӧ�ã���Ŀ�Ѷ��еȣ��ƶ�Ԫ�ص������ǹؼ���ע������ԭ�ӽṹ��Ԫ�������ɡ�Ԫ�����ڱ��Ĺ�ϵ������������ѧ�������Ӧ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͬ�����ͬŨ�ȵ�NaF��NaCl��Һ�У���������������N��NaCl����N��NaF����ͬ���ͬŨ�ȵ�Na2CO3��Na2SO4��Һ�У���������������N��Na2CO3����N��Na2SO4�� | |||||||||||
| B�� | ������ij�¶��¸����ᡢ���ᡢ����������ڱ������еĵ��볣�������ڱ�����������ĵ��뷽��ʽ�ɱ�ʾΪH2SO4?2H++SO42-
| |||||||||||
| C�� | ��֪����HF��CH3COOH��pH��ȵ�NaF��CH3COOK��Һ�У�[c��Na+��-c��F-��]��[c��K+��-c��CH3COO-��] | |||||||||||
| D�� | ƽ����ϵCaCO3��s��?CaO��s��+CO2�н�����̼��ơ������Ƽ�������̼���壮ijʱ�̣������¶Ȳ��䣬�����������СΪԭ����һ�벢���ֲ��䣬�������̼Ũ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
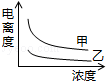 B��
B�� C��
C��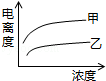 D��
D��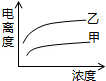
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
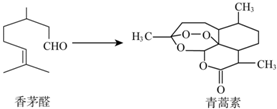
| A�� | ��éȩ��ʹBr2��CCl4��Һ��ɫ | |
| B�� | �����ط���ʽΪC15H22O5 | |
| C�� | ��������һ�������¿ɷ���ˮ�ⷴӦ | |
| D�� | ���߾��������������ӳɷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

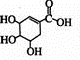 +Br2��
+Br2��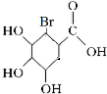 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CO��g���TC��s��+$\frac{1}{2}$O2��g�� | B�� | 2N2O5��g���T4NO2��g��+O2��g�� | ||
| C�� | ��NH4��2CO3��s���TNH4HCO3��s��+NH3��g�� | D�� | MgCO3��s���TMgO��s��+CO2��g�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH4+��Mg2+��SO42-��Cl- | B�� | K+��Cl-��HCO3-��SO42 | ||
| C�� | Al3+��Cu2+��SO42-��Cl- | D�� | Ca2+��S2-��Na+��NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 10��1 | B�� | 1��10 | C�� | 2��1 | D�� | 1��1 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com