
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是
A.在含AlO2-、SO32-、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO2-、SO32-
B.含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+
C.含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:KOH、Ba(OH)2、K2CO3、BaCO3
D.在含Fe3+、H+、NH4+的溶液中逐渐加入烧碱溶液:H+、NH4+、Fe3+
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源:2015-2016学年河南省高二上学期第二次月考化学试卷(解析版) 题型:选择题
pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如图所示。分别滴加NaOH溶液(c=0.1 mol/L)至pH=7,消耗NaOH溶液的体积为Vx、Vy,则
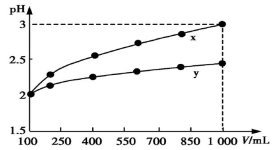
A.x为弱酸,Vx<Vy B.x为强酸,Vx>Vy
C.y为弱酸,Vx<Vy D.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省黄石市高一上11月期中月考化学试卷(解析版) 题型:填空题
图1是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。
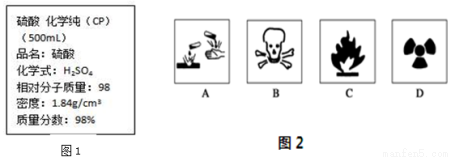
Ⅰ.(1)在盛放浓硫酸的试剂瓶的标签上应印有图2警示标志中的____________。
(2)若将该浓硫酸与等质量的水混合,则所得溶液中溶质物质的量浓度_________9.2mol/L(填>、<、=)。
Ⅱ.现欲用该浓硫酸配制成1mol/L的稀硫酸,现实验室仅需要这种稀硫酸220mL。试回答下列问题:
(3)用量筒量取该浓硫酸______________ mL。
(4)配制时,必须使用的仪器除量筒、烧杯外,还缺少的仪器是_________________。
(5)若在稀释过程中,浓硫酸不慎沾在手上,处理方法为 。
(6)配制溶液的过程中,其他操作都正确,下列操作会使所配溶液浓度偏高的是____________。
A.用量筒量取浓硫酸时俯视
B.稀释浓硫酸时,未冷却到室温即转移到容量瓶中
C.量取浓H2SO4后的量筒进行洗涤,并将洗涤液转移到容量瓶中
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切
E.容量瓶不干燥
F.定容时,俯视容量瓶刻度线
查看答案和解析>>
科目:高中化学 来源:2015-2016学年上海市高二上学期期中测试化学试卷(解析版) 题型:选择题
Fe3O4与HNO3反应生成Fe(NO3)3、NO、H2O若溶解1mol Fe3O4,则被还原的硝酸是
A、3 mol B、1/2 mol C、1/3 mol D、9 mol
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三11月月考化学试卷(解析版) 题型:填空题
(一)(1)钠及其化合物是中学化学常用物质,核潜艇或宇宙飞船常用过氧化钠做供氧剂,其原理是_______________________________、_______________________________(用化学方程式表示),若上述变化过程中消耗过氧化钠的质量为 23.4g,则变化过程中转移电子数为_____________个。
23.4g,则变化过程中转移电子数为_____________个。
(2)下列关于Na2O2的叙述正确的是__________
A.Na2O2中阴、阳离子的个数比为1∶1
B.Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等
C.取a g某物质在O2中完全燃烧,将生成物与足量Na2O2固体完全反应,反应后,固体质量恰好也增加了a g,该物质可能是C6H12O6
D.Na2O2的漂白原理与SO2的漂白原理相同
E.Na2O2与水反应是水作还原剂的氧化还原反应
F.Na2O2与NaHCO3固体按物质的量之比1:1混合加热充分反应后,所得固体中Na2CO3和NaOH的物质的量之比亦为1:1
(二)切开的金属Na暴露在空气中,其变化过程如下:

(1)反应Ⅰ的反应过程与能量变化的关系如右图:

① 反应Ⅰ 是 反应(填“放热”或“吸热”),判断依据是_________________________________。
② 1 mol Na(s)全部氧化成Na2O(s)的热化学方程式是 _________________________________。
(2)白色粉末为Na2CO3。将其溶于水配制为0.1 mol/L Na2CO3溶液,下列说法正确的是 (填字母)。
Na2CO3溶液,下列说法正确的是 (填字母)。
A.升高温度,溶液的pH降低
B.c(OH-)-c (H+)=c (HCO3-)+2 c (H2CO3)
C.加入少量NaOH固体,c (CO32―)与c (Na+)均增大
D.c (Na+) > c (CO32―) > c (HCO3―) > c(OH―) > c (H+)
(3) 钠电池的研究开发在一定程度上可缓和因锂资源短缺引发的电池发展受限问题。
① 钠比锂活泼,用原子结构解释原因___________________________________。
② ZEBRA 电池是一种钠电池,总反应为NiCl2 + 2Na 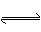 Ni + 2NaCl。其负极反应式是____________
Ni + 2NaCl。其负极反应式是____________
查看答案和解析>>
科目:高中化学 来源:2016届宁夏育才中学高三上学期第四次月考化学试卷(解析版) 题型:选择题
常温下,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液②NaOH溶液③CH3COONa溶液,下列说法中正确的是(忽略混合前后溶液体积变化)( )
A.溶液的pH值:①>③>②
B.水电离出的c(OH-):③>①=②
C.①和③等体积混合后的溶液:c(CH3COOH)+c(CH3COO-)=0.1mol/L
D.②和③等体积混合后的溶液:c(Na+)=c(CH3COOH)+c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源:2016届宁夏育才中学高三上学期第四次月考化学试卷(解析版) 题型:选择题
下列有关物质性质的应用正确的是( )
A.液氨汽化时要吸收大量的热,可用作制冷剂
B.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸
C.生石灰能与水反应,可用来干燥氯气
D.氯化铝是一种电解质,可用于电解制铝
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江余姚中学高一上学期期中考试化学试卷(解析版) 题型:选择题
下列叙述中,正确的是
A.次氯酸能杀死病菌,所以氯气可用于自来水的消毒
B.实验室制取氯气时,常用水来吸收多余的氯气
C.漂白粉中含有次氯酸,所以漂白粉能使染料等有机色素褪色
D.氯气不能使干燥的有色布条褪色,液氯能使干燥的有色布条褪色
查看答案和解析>>
科目:高中化学 来源:2016届河北邯郸第一中学高三一轮收官考试一理综化学卷(解析版) 题型:实验题
某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为___________________________。
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
_____MnO4-+_____H2C2O4+____H+ = ____Mn2++_____CO2+____H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):
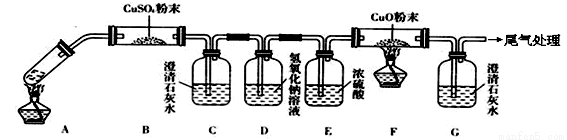
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:
上述装置中,D的作用是______。乙二酸分解的化学方程式为__________。
(4)该小组同学将2.52g草酸晶体(H2C2O4·2 H2O)加入到100mL0.2mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是_______(用文字简单描述)。
(5)以上溶液中各离子的浓度由大到小的顺序为:_________(用离子符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com