
| A. | CaF2 | B. | Na2O | C. | CuSO4•5H2O | D. | FeCl3 |
科目:高中化学 来源: 题型:选择题
| A. | Y单质不能与X的氢化物反应 | |
| B. | Y的氢化物是离子化合物 | |
| C. | 工业上冶炼Z通常用电解其熔融氯化物的方法 | |
| D. | W单质既能与酸反应,又能与碱反应,属于两性物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液不能盛装在玻璃塞的试剂瓶中 | |
| B. | 饱和食盐水使甲基橙显黄色 | |
| C. | FeCl3溶液加热蒸干得到Fe2O3 | |
| D. | 0.1mol/LCuCl2溶液中,c(Cu2+)<0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 21.2 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
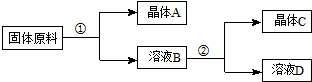
| A. | ①和②的实验过程中,都需要控制温度 | |
| B. | ①实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤 | |
| C. | ②实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤 | |
| D. | 用95%的酒精洗涤所得的硝酸钾晶体比较好 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com