
| A. | ①或② | B. | ②或④ | C. | ①或③ | D. | ③或④ |
分析 室温下,pH=11的某溶液中,如果溶质是碱,则溶液中水电离出的c(OH-)=c(H+),如果是强碱弱酸盐,则溶液中水电离出的c(OH-)=$\frac{Kw}{c({H}^{+})}$,据此分析解答.
解答 解:室温下,pH=11的某溶液中,如果溶质是碱,则溶液中水电离出的c(OH-)=c(H+)=10-11 mol/L,如果是强碱弱酸盐,则溶液中水电离出的c(OH-)=$\frac{Kw}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=10-3 mol/L,
故选D.
点评 本题以水的电离为载体考查盐类水解,为高频考点,注意:该溶液呈碱性,溶液中的溶质可能是碱或强碱弱酸盐,很多同学往往漏掉碱而导致错误,为易错题.


科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同质量的NO和C2H4 (气体)体积相同 | |
| B. | 同温同压下,相同体积的H2和CO2的原子数之比为2:3 | |
| C. | 同温同压下,气体的密度之比等于摩尔质量之比 | |
| D. | 同温同体积的气体,若物质的量相同则压强相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 刚充入时反应速率υ正减少,υ逆增大 | |
| B. | 平衡向正反应方向移动 | |
| C. | 平衡向逆反应方向移动 | |
| D. | 物质C的质量分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 117号元素最高正价应为+7 | |
| B. | 核素293117Ts中中子数与质子数之差为176 | |
| C. | 117号元素衰变成115号元素和113号元素是化学变化 | |
| D. | 117号与115号元素的原子质量比为117:115 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
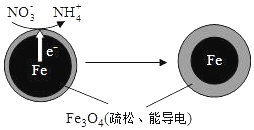 用零价铁(Fe)去除水体中的硝酸盐(NO3- )已成为环境修复研究的热点之一.
用零价铁(Fe)去除水体中的硝酸盐(NO3- )已成为环境修复研究的热点之一.| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 | 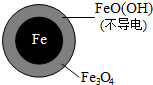 |  |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol/L的NaHA其PH=1,溶液中存在:c(Na+)+c(H+)=c(OH-)+2c(A2-)+c(HA-) | |
| B. | 40%的醋酸溶液(p=1.049gcm-3)与60%的醋酸溶液(p=1.064gcm-3)等体积混合后,所得溶液中溶质的质量分数大于50% | |
| C. | 0.1mol/L的醋酸溶液V1L和等浓度的氢氧化钠溶液V2L混合后呈碱性,则一定有V1≤V2 | |
| D. | 1L0.5mol/LFeCl3的溶液与0.2L1mol/LKCl溶液中Cl-数目之比为15:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大气中的SO2、NO2是酸性氧化物,与酸雨的形成密切相关 | |
| B. | 氢氧化铝常用于治疗胃酸过多,过量服用会造成重金属中毒 | |
| C. | 制豆腐时向豆浆中加入硫酸钙使蛋白质等聚沉,可制成豆腐 | |
| D. | 氢氧燃料电池是一种高能电池,释放的电能与等量氢气完全燃烧释放的热能相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com