
【题目】下列物质的沸点由高到低排列的是( ) ①CH3(CH2)2CH3
②CH3(CH2)3CH3
③(CH3)3CH
④(CH3)2CHCH2CH3 .
A.②④①③
B.④②③①
C.④②①③
D.②④③①
科目:高中化学 来源: 题型:
【题目】燃煤厂为减少SO2的排放,可采取的措施是:
①洗涤含SO2的烟气,下列物质可作洗涤剂的是 .
a.浓NH3H2O b.NaHCO3 c.FeCl3 d.NaHSO3
②将煤转化为清洁气体燃料,过程如图所示: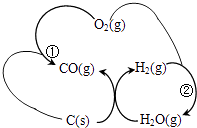
已知:反应①生成1molCO(g)的反应热△H=﹣110.5KJ/mol反应②生成1molH2O(g)的反应热△H=﹣241.6KJ/mol焦炭与水蒸气反应的热化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料。粗食盐常含有少量Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaC1的流程如下:
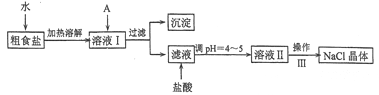
(1)加入A试剂,是为了除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子。A代表的是多种试剂,按滴加顺序依次为:iNaOH,ⅱ__________,ⅲ_________(填化学式)。
(2)请写出下列试剂加入试剂i时发生主要反应的离子反应方程式:_________
(3)右下图是某学生的过滤操作示意图,其操作不规范的是________(填标号)。
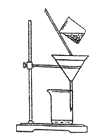
a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(4)操作III的名称是__________
(5)mg粗盐提纯后得到ng纯净的NaCl固体,则m与n的大小关系为_________.
A.m>n B. m=n C. m<n D. 无法确定.
(6)实验室需配制480 mL0.400mol/L盐酸,现用如图所示浓盐酸配制,回答下列问题:
盐酸
分子式: HCl
相对分子质量: 36.5
密度: 1.2g/cm3
HCl的质量分数为: 36.5%
①配制需要的玻璃仪器有玻璃棒、量简、烧杯、________(填仪器名称)
②需量取浓盐酸的体积为:__________mL。(结果保留1位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】8.34g FeSO47H2O样品在隔绝空气条件下受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.下列说法中正确的是( ) 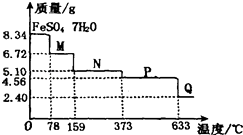
A.温度为78℃时固体物质M的化学式为FeSO4?5H2O
B.温度为l59℃时固体物质N的化学式为FeSO4?3H2O
C.在隔绝空气条件下由N得到P的化学方程式为FeSO4 ![]() ?FeO+SO3↑
?FeO+SO3↑
D.取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下图所示的仪器来制取氧气并测量氧气的体积。图中E为量气装置。

本实验可供选用的药品还有:稀硫酸、稀盐酸、过氧化钠、大理石、水。
试回答:
(1)图中装置的连接顺序是(填装置的字母编号),其中连接胶管及支持装置省略:_________。
(2)装置C中放入的反应物是________和_________________。(写化学式)
(3)装置A的作用是__________________;装置B的作用是_______________。
(4)装置D中发生的化学反应方程式为__________________________。
(5)为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,在读反应前后甲管中液面的读数求其差值的过程中,应注意_____________。
a.视线与凹液面最低处相平
b.等待片刻,待乙管中液面不再上升时,立刻读数。
c.读数时应上下移动乙管,使甲、乙两管液面相平。
d.读数时不一定使甲、乙两管液面相平。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中,产生NO的反应为:N2(g)+O2(g)2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化.下列叙述正确的是( ) 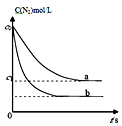
A.若曲线b对应的条件改变是温度,可判断该反应的△H<0
B.温度T下,随着反应的进行,混合气体的密度减小
C.曲线b对应的条件改变可能是加入了催化剂
D.温度T下,该反应的平衡常数K= ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是硫的重要化合物,在生产、生活中有广泛应用.二氧化硫有毒,并且是形成酸雨的主要气体.无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要.完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫. 
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是(填写字母).
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠g(保留一位小数);如果已有40%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠g (保留一位小数).
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通.石灰﹣石膏法和碱法是常用的烟气脱硫法.
石灰﹣石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O.吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO42H2O.其流程如图1,碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O.碱法的特点是氢氧化钠碱性强、吸收快、效率高.其流程如图2:
已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收SO2的成本(元/mol) | 0.027 | 0.232 |
石灰﹣石膏法和碱法吸收二氧化硫的化学原理相同之处是 . 和碱法相比,石灰﹣石膏法的优点是 , 缺点是 .
(4)在石灰﹣石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定温度一定的密闭容器中发生反应M2(?)+2R2(g)M2R4(g),加入1mol M2和2molR2 , 反应过程中测得气体的平均相对分子质量随时间的变化如图所示.则下列说法错误的是( ) 
A.M2既可能为固体,也可能为气体
B.达到平衡后,保持容器容枳和温度不变,再加入1molM2和2molR2 , 则R2转化率不变
C.达到平衡后,保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,R2的浓度可能是原平衡时的1.8倍
D.若M2为气体,达到平衡后,保持容器容积和温度不变,再加入1molM2R4 , 则新的平衡时气体的平均相对分子质量增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com