
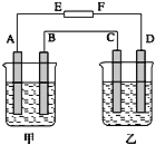
【题目】如下图所示,甲烧杯中盛有100mL0.50molL-1AgNO3溶液,乙烧杯中盛有100mL0.25molL-1CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重3.8g,求此时甲、乙装置中共产生多少升气体?(标准状况下)
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】下图表示800℃时A、B、C三种气体物质的浓度随时间变化的情况,t是到达平衡状态的时间。试回答:

(1)该反应的反应物是______。
(2)该反应的化学反应方程式为__________。
(3)若达到平衡状态的时间是2 min,A物质的平均反应速率为(写出简要的计算过程)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德常数为NA。则下列说法正确的是
A、常温常压下,11.2L甲烷中含有的氢原子数为2NA
B、标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA
C、常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
D、常温下,1L 0.1mol/L MgCl2溶液中含Mg2+数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙、丁四个装置,下列有关说法不正确的是

A.选用合适的试剂,使用甲装置在实验室可以制备少量H2、O2、CO2、Cl2、NO2、NH3
B.采用不同的通气方法,使用乙装置可收集H2、NH3、CO、NO、SO2、O2、Cl2
C.选用丙装置处理尾气,可以吸收Cl2、SO2、H2S、NO2、HCl
D.选用丁装置可以净化NH3(H2O)、O2(CO2)、H2(HCl)(括号内为杂质气体)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用密度为1.2g/mL、质量分数为36.5%的浓盐酸来配制90mL 0.8mol/L的稀盐酸.可供选择的仪器有:①玻璃棒 ②托盘天平 ③50mL烧杯 ④药匙 ⑤胶头滴管 ⑥量筒.
请回答下列问题:
(1)上述仪器中,在配制稀盐酸时需要使用的有(填序号),还缺少的仪器是(填仪器名称).
(2)计算:所需浓盐酸的物质的量浓度为 , 量取浓盐酸的体积为mL.量取浓盐酸时应选用量筒的规格为
①10mL ②50mL ③100mL
(3)将所配制的稀盐酸进行测定,发现浓度大于0.8mol/L.请你分析配制过程中可能引起浓度偏高的原因(答出两点)、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中能用平衡移动原理解释的是
A. 使用催化剂可加快氨的合成速率
B. 在FeSO4溶液中,加入铁粉以防止氧化
C. 由H2蒸气、I2蒸气、HI组成的平衡体系加压后颜色变深
D. 硫酸工业生产中,通入过量空气以提高SO2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有等体积、等pH值的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是( )
A. V3>V2=V1 B. V3=V2=V1 C. V3>V2>V1 D. V1=V2>V3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2015新课标Ⅱ]用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com