


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案科目:高中化学 来源: 题型:




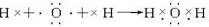
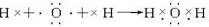






查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
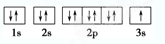

查看答案和解析>>
科目:高中化学 来源:2013届福建师大附中高二下学期期中考试化学试卷(解析版) 题型:填空题
(15分)(1)化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中一种异构体易溶于水,则此种化合物是 (填“极性”、“非极性”)分子。
(2)今有A、B、C、D四种元素,它们的原子序数依次增大,且均小于18,A和B在同一周期,A原子p能级有一个空轨道,B原子的p能级有两个未成对电子,0.1mol C单质能从酸中置换出 2.24L氢气(标准状态),此时它就变成与B离子电子层排布完全相同的离子。D离子的半径在B、C、D中为最小。则:
①A是_________,B是_________,C是_________,D是__________。(填名称)
②A单质和B单质充分反应生成的化合物的电子式是____________。
③我国科学工作者于20世纪90年代在兰州制备出过去一直依赖进口,价格十分昂贵的B的一种同位素形成的单质,1mol这种单质中含中子的物质的量是20mol,则这种同位素原子的符号为________。
(3)NH3·H2O的电离方程式为NH3·H2O NH4++OH-,试判断溶于水后,形成的合理结构是________。(填右图中的字母)
NH4++OH-,试判断溶于水后,形成的合理结构是________。(填右图中的字母)

(4)把CoCl2溶于水后加氨水直到先生成的Co(OH)2沉淀又溶解后,再加氨水,使生成[Co(NH3)6]2+,此时向溶液中通入空气,得到的产物中有一种其组成可用CoCl3·5NH3表示,Co的配位数是6。把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀。经测定,每1molCoCl3·5NH3只生成2molAgCl。CoCl3·5NH3中Co化合价为 ,请写出表示此配合物结构的化学式: ,
(5)核内中子数为N的R2+,质量数为A,则ng它的氧化物中所含质子的物质的量是
(6)Mg晶体的熔点比Na晶体 (填“高”或“低”),原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com