
| A. | 乙醇汽油是纯净物,汽油是混合物 | |
| B. | 推广使用乙醇汽油是为了减少温室气体排放 | |
| C. | 推广使用乙醇汽油是为了减少化石燃料消耗 | |
| D. | 用粮食生产乙醇是开发新能源的发展方向 |
分析 A、乙醇汽油是乙醇和普通汽油的混合物;
B、乙醇和汽油燃烧均能生成二氧化碳;
C、汽油是由石油分馏得到,不可再生,而乙醇可以再生;
D、用粮食生产乙醇会造成粮食的浪费.
解答 解:A、汽油本身即混合物,而乙醇汽油是乙醇和普通汽油的混合物,故A错误;
B、乙醇和汽油燃烧均能生成二氧化碳,故推广乙醇汽油不能减少温室气体的排放,故B错误;
C、汽油是由石油分馏得到,石油是化石燃料不可再生,故汽油不可再生,而乙醇可以再生,故推广乙醇汽油可以减少化石燃料的消耗,故C正确;
D、粮食是一个国家重要的资源,是百姓的根本,用粮食生产乙醇会造成粮食的浪费,应该用植物的秸秆来生产,故D错误.
故选C.
点评 本题考查了新能源---乙醇汽油,但应意识到,乙醇汽油只能在某种程度上减少化石能源的消耗,但不能从根本上解决燃料的燃烧对环境的污染问题.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 25℃,1.01×105Pa,11.2L Cl2含有的分子数小于0.5NA | |
| B. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为1NA | |
| C. | 1molFeCl3与沸水反应生成NA个Fe(OH)3胶粒 | |
| D. | 常温下,23 g NO2含有2NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
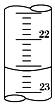 中和滴定的相关问题
中和滴定的相关问题| 滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;Y的价电子轨道表示式为
;Y的价电子轨道表示式为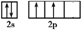 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
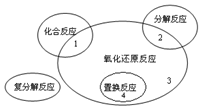 (1)氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是D
(1)氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是D查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在1~100 nm之间 | |
| B. | 溶液呈电中性,胶体带有电荷 | |
| C. | 溶液中分散质微粒能透过滤纸,胶体中分散质微粒不能透过滤纸 | |
| D. | 制备氢氧化铁胶体时,可以将饱和FeCl3溶液滴入沸水,然后长时间煮沸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 多吃肉,少吃蔬菜水果 | |
| B. | 合理摄入糖类.油脂等,注意膳食平衡 | |
| C. | 为防止变胖,炒菜时不放油 | |
| D. | 适量饮用矿泉水对身体健康有益 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合溶液的PH=7 | B. | 混合溶液中,C(H+)=$\sqrt{Kw}$mol•L-1 | ||
| C. | a=b | D. | 混合溶液中,C(H+)+C(B+)=C(OH-)+C(A-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com