
| A. | 元素的原子半径呈周期性变化 | |
| B. | 元素原子量的递增,量变引起质变 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素原子的核外电子排布呈周期性变化 |
分析 元素的金属性和非金属性、元素的原子半径都属于元素的性质;元素的相对原子质量递增,但不呈现周期性的变化;结构决定性质,元素原子的核外电子排布的周期性变化导致元素性质的周期性变化.
解答 解:A、元素的原子半径属于元素的性质,原子半径周期性变化是原子的电子排布周期性变化的结果,故A错误;
B、元素的原子的相对原子质量增大,但不呈现周期性的变化,则不能决定元素性质出现周期性变化,故B错误;
C、元素金属性或非金属性都属于元素的性质,元素的金属性和非金属性的周期性变化是原子的电子排布周期性变化的结果,故C错误;
D、由原子的电子排布可知,随原子序数的递增,电子层数和最外层电子数都呈现周期性的变化而引起元素性质的周期性变化,即原子的电子层排布的周期性变化是引起元素性质周期性变化的决定因素,故D正确;
故选D.
点评 本题主要考查的是元素周期律的实质,理解元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果,难度不大.


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用焓变或熵变的数据一定都能单独判断反应的自发性 | |
| B. | 利用沸点数据推测一些液体混合物分离开来的可能性 | |
| C. | 利用反应热数据的大小判断不同反应的反应速率的大小 | |
| D. | 利用溶液的pH与7的大小关系来判断任何温度下溶液的酸碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,含NA个氩原子的氩气的体积约为11.2 L | |
| B. | 31g白磷分子中,含有的共价单键数目是NA个 | |
| C. | 6 g金刚石晶体中含有的碳碳键数目为2×6.02×1023 | |
| D. | 4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1<Q2 | |
| B. | 生成物总能量均高于反应物总能量 | |
| C. | 生成1 mol HCl气体时放出Q1热量 | |
| D. | 1 mol HBr(g)具有的能量大于1 mol HBr(l)具有的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
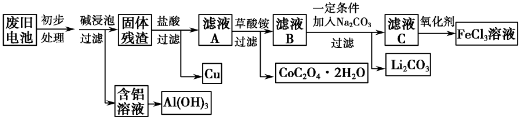
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制碱性Cu(OH)2悬浊液 | B. | FeCl3溶液 | ||
| C. | BaCl2溶液 | D. | 酸性KMnO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com