
分析 (1)因为20ml滤液与足量铁粉生成22.4ml氢气,其中氢气的物质的量为$\frac{22.4×0.001}{22.4}$=0.001mol,即20ml滤液中含有0.001×2=0.002mol氢离子,所以滤液中氢离子浓度为$\frac{0.002}{20×0.001}$=0.1mol/L,由此求溶液的pH;
(2)因为氢氧化钡质量为5.13克,即0.03mol,而生成的硫酸钡沉淀只有5.825克,即0.025mol,故原溶液中有硫酸根离子0.025mol,所以原混合液中硫酸根离子浓度为$\frac{0.025mol}{100×0.001L}$=0.25mol/L,因为Ba(OH)2+H2SO4=BaSO4 ↓+2H2O,氢氧化钡与硫酸反应后剩余0.005mol,0.005mol氢氧化钡将与盐酸完全反应,而后剩余的盐酸可以与铁完全反应生成0.001×5=0.005mol氢气,这里氢离子的总和为0.005×2+0.005×2=0.02mol,由此分析求解.
解答 解:(1)因为20ml滤液与足量铁粉生成22.4ml氢气,其中氢气的物质的量为$\frac{22.4×0.001}{22.4}$=0.001mol,即20ml滤液中含有0.001×2=0.002mol氢离子,所以滤液中氢离子浓度为$\frac{0.002}{20×0.001}$=0.1mol/L,所以滤液pH为 pH=-lg0.1=1.即滤液pH为1,
答:滤液的pH为1;
(2)因为氢氧化钡质量为5.13克,即0.03mol,而生成的硫酸钡沉淀只有5.825克,即0.025mol,故原溶液中有硫酸根离子0.025mol,所以原混合液中硫酸根离子浓度为$\frac{0.025mol}{100×0.001L}$=0.25mol/L,因为Ba(OH)2+H2SO4=BaSO4 ↓+2H2O,氢氧化钡与硫酸反应后剩余0.005mol,0.005mol氢氧化钡将与盐酸完全反应,而后剩余的盐酸可以与铁完全反应生成0.001×5=0.005mol氢气,这里氢离子的总和为0.005×2+0.005×2=0.02mol,因为这里的氢离子全由盐酸提供,即氯离子也是0.02mol,
故氯离子浓度为$\frac{0.02}{100×0.001}$=0.2mol/L,
答:原混合液中氯离子浓度为 0.2mol/L,硫酸根离子的浓度为0.25mol/L.
点评 本题考查化学方程式的计算,难度中等,清楚发生的反应是关键,注意根据离子方程式计算生成氢离子的物质的量.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 电解NaOH溶液时,溶液浓度将增大,pH增大 | |
| B. | 电解H2SO4溶液时,溶液浓度将增大,pH增大 | |
| C. | 电解Na2SO4溶液时,溶液浓度将增大,pH不变 | |
| D. | 电解NaCl溶液时,溶液浓度将减小,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 实验内容 | 实验目的 |
| A | 常温下,测得饱和Na2CO3溶液的pH大于饱和 NaHCO3溶液的pH | 比较常温下水解程度: CO32->HCO3- |
| B | 向2mL甲苯中加入3滴KMnO4酸性溶液,振荡; 向2mL己烷中加入3滴KMnO4酸性溶液,振荡 | 证明与苯环相连的甲基易被氧化 |
| C | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶 液,前者为黄色,后者为红褐色 | 证明温度升高,Fe3+的水解程度 增大 |
| D | 向盛有10滴0.1mol/LAgNO3溶液的试管中滴加0.1mol/L NaCl溶液,至不再有沉淀生成,再向其中滴加0.1mol/L Na2S溶液 | 证明AgCl沉淀能转化为溶解度更小 的Ag2S沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g) 所具有的总能量低 | |
| B. | 氢气的燃烧热为△H=-241.8 kJ•mol-1 | |
| C. | H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 | |
| D. | 液态水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
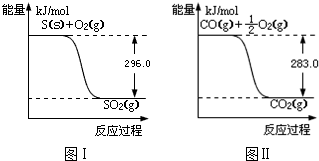
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
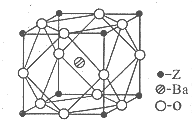 A、B、C、D、Z为周期表前四周期元素,原子序数依次递增,已知:
A、B、C、D、Z为周期表前四周期元素,原子序数依次递增,已知:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
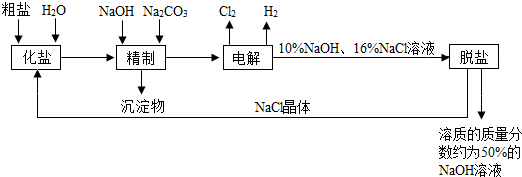
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液A的体积(mL) | KMnO4标准溶液的体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 20.00 | 0.10 | 20.12 |
| 第二次 | 20.00 | 2.20 | 24.20 |
| 第三次 | 20.00 | 4.30 | 24.28 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com