
 如图装置,在关闭活塞K时通入气体X,b中溶液没有明显现象;开启活塞K通入气体X,则b中溶液有明显现象,下列判断中合理的是( )
如图装置,在关闭活塞K时通入气体X,b中溶液没有明显现象;开启活塞K通入气体X,则b中溶液有明显现象,下列判断中合理的是( )| a中溶液 | b中溶液 | 气体X | |
| A | 饱和食盐水 | KI-淀粉溶液 | Cl2 |
| B | 酸性KMnO4溶液 | 稀品红溶液 | SO2 |
| C | 饱和NaHS溶液 | CuCl2溶液 | HCl |
| D | 饱和NaHCO3溶液 | 石灰水 | CO2 |
| A、A | B、B | C、C | D、D |


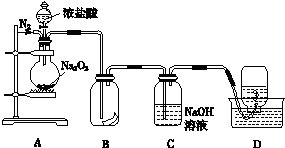
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 苯和溴取代反应的实验装置如图所示,其中A为由具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉.填写下列空白:
苯和溴取代反应的实验装置如图所示,其中A为由具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉.填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用10mL量筒量取7.8mL浓H2SO4 |
| B、用碱式滴定管量取18.20mLKMnO4溶液 |
| C、酸碱中和滴定时,滴定管和锥形瓶需分别用标准液和待测液润洗 |
| D、读取标准液读数时,若滴定前仰视,滴定后俯视,会导致测定结果偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起.气体X和液体Y不可能是( )
如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起.气体X和液体Y不可能是( )| X | Y | |
| A | HCl | 饱和食盐水 |
| B | CO2 | 稀H2SO4 |
| C | SO2 | NaOH |
| D | H2S | 溴水 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
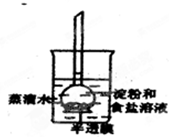 如图所示,烧杯内装有蒸馏水,下部封有半透膜的长颈漏斗内装有淀粉和食盐溶液,漏斗颈内的液面略高于烧杯内蒸馏水的液面,过一段时间后用碘水和硝酸银溶液分别检验蒸馏水中的物质.整个实验过程中,所观察到的现象是( )
如图所示,烧杯内装有蒸馏水,下部封有半透膜的长颈漏斗内装有淀粉和食盐溶液,漏斗颈内的液面略高于烧杯内蒸馏水的液面,过一段时间后用碘水和硝酸银溶液分别检验蒸馏水中的物质.整个实验过程中,所观察到的现象是( )| A、漏斗颈内液面下降 |
| B、漏斗颈内液面上升 |
| C、烧杯内液体遇硝酸银溶液没有白色沉淀生成 |
| D、烧杯内液体遇碘水变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有氨水、醋酸、盐酸、氯化铵四种溶液,请回答下列问题:
现有氨水、醋酸、盐酸、氯化铵四种溶液,请回答下列问题:| C(NH3?H2O) |
| C(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质名称 | 溶度积(Ksp) | pH | |
| 开始沉淀 | 完全沉淀 | ||
| Mg(OH)2 | 5.6×10-12 | 9.3 | 10.8 |
| Fe(OH)2 | 8.0×10-16 | 7.6 | 9.6 |
| Fe(OH)3 | 2.8×10-39 | 2.7 | 3.7 |
| Al(OH)3 | 1.3×10-33 | 3.7 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 25℃时,20mL0.1mol?L-1氨水溶液中逐滴加入0.2mol?L-1HCl溶液(如图),下列说法正确的是( )
25℃时,20mL0.1mol?L-1氨水溶液中逐滴加入0.2mol?L-1HCl溶液(如图),下列说法正确的是( )| A、在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B、在C点,c<10,且有c(NH4+)=c(Cl-)=c(OH-)=c(H+) |
| C、若25℃时 0.1mol/L 氨水电离度为1.33%,则b<a<12 |
| D、在D点:c(NH4+)+c(NH3?H2O)=2c(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com