
氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇,熔点422 ℃,沸点1366 ℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42-等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺如下:

(1)在粗盐除杂的反应I中加Na2CO3溶液的作用是 ;
滤渣的主要成分: 。
(2)反应Ⅱ完成后溶液中主要溶质是 。
(3)反应IV和VI都是制备CuCl的化学过程:
①反应IV加入的Cu必须过量,其目的是 。
②写出反应VI的离子方程式 。
(4)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70 ℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是 。
(1)除去Ca2+和过量的Ba2+ BaSO4、CaCO3、Mg(OH)2 、BaCO3 (2)NaCl
(3)防止生成CuCl2 2Cu2++2Cl-+SO2+2H2O = 2CuCl↓+4H++SO42-
(4)加快乙醇和水的蒸发,防止CuCl被空气氧化
【解析】
试题分析:(1)分析流程图知,反应Ⅰ为粗盐的提纯,为保证杂质离子除尽所加试剂要过量,加过量氯化钡溶液除硫酸根,加过量Na2CO3溶液可以粗盐溶液中的除去Ca2+和除去硫酸根离子所加的过量的Ba2+,加过量氢氧化钠溶液除镁离子;答案为:除去Ca2+和过量的Ba2+;(2)分析流程图知,反应Ⅱ完成后溶液中主要溶质是氯化钠;(3)①反应Ⅳ加入的Cu必须过量,金属铜可以和铜离子在溶液中生成亚铜离子,这样可以防止生成CuCl2;②二氧化硫和硫酸铜之间可以发生氧化还原反应生成氯化亚铜沉淀,反应的离子方程式为2Cu2++2Cl-+SO2+2H2O = 2CuCl↓+4H++SO42-;(4)根据题给信息知,氯化亚铜(CuCl)在空气中迅速被氧化成绿色,CuCl沉淀在真空干燥机内于70℃干燥2小时的目的是加快乙醇和水的蒸发,防止CuCl被空气氧化。
考点:考查物质的分离、提纯和制备,离子方程式的书写。


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
(1)CuCl制备过程中需要配制质量分数为20.0%的CuSO4溶液,试计算配制该溶液所需的CuSO4·5H2O与H2O的质量之比。
(2)准确称取所制备的0.250 0 g CuCl样品置于一定量的0.5 mol·L-1 FeCl3溶液中,待样品完全溶解后,加水20 mL,用0.100 0 mol·L-1的Ce(SO4)2溶液滴定到终点,消耗24.60 mL Ce (SO4)2溶液。有关化学反应为:
Fe3+CuCl====Fe2++Cu2++Cl-
Ce4++Fe2+====Fe3++Ce3+
通过计算说明上述样品中CuCl的质量分数是否符合标准。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省八校高三第二次联考理综化学试卷(解析版) 题型:填空题
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:


根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法是______________、氯碱工业的装置是_____________________。
(2)写出生产过程中X__________? Y___________ (填化学式)
(3)写出产生CuCl的化学方程式________________________________________________________。
(4)生产中为了提高CuCl产品的质量,采用______________法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是______________________________;生产过程中调节溶液的pH不能过大的原因是______________________________。
(5)在CuCl的生成过程中理论上不需要补充SO2气体,其理由是__________________________。
(6)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是:
_____________________________________。
(7)氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放入玻璃珠50粒和10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;玻璃珠的作用是____________________________。
②待样品溶解后,加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次。已知:CuCl + FeCl3 =CuCl2 + FeCl2????? Fe2+ + Ce4+ = Fe3+ + Ce3+
如此再重复二次测得:
| 1 | 2 | 3 |
空白实验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
④数据处理:计算得CuCl的纯度为____________。(平行实验结果相差不能超过0.3%)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省株洲市高三第四次月考化学试卷(解析版) 题型:填空题
氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇,熔点422 ℃,沸点1366 ℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42-等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺如下:

(1)在粗盐除杂的反应I中加Na2CO3溶液的作用是 ;
滤渣的主要成分: 。
(2)反应Ⅱ完成后溶液中主要溶质是 。
(3)反应IV和VI都是制备CuCl的化学过程:
①反应IV加入的Cu必须过量,其目的是 。
②写出反应VI的离子方程式 。
(4)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70 ℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省株洲市高三第四次月考化学试卷(解析版) 题型:填空题
氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇,熔点422 ℃,沸点1366 ℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42-等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺如下:
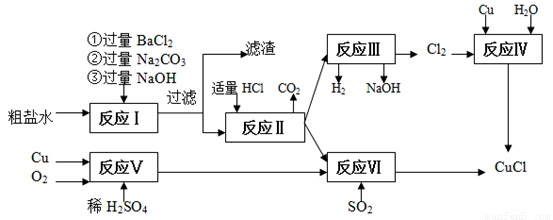
(1)在粗盐除杂的反应I中加Na2CO3溶液的作用是 ;
滤渣的主要成分: 。
(2)反应Ⅱ完成后溶液中主要溶质是 。
(3)反应IV和VI都是制备CuCl的化学过程:
①反应IV加入的Cu必须过量,其目的是 。
②写出反应VI的离子方程式 。
(4)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70 ℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com