
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源:2016-2017学年河北省高一12月月考化学试卷(解析版) 题型:选择题
足量的锌和下列酸反应,产生H2的物质的量最多的是( )
A.10mL 18.4mol/L H2SO4  B.30mL 3mol/L盐酸
B.30mL 3mol/L盐酸
C.30mL 2mol/L H2SO4 D.30mL 5 mol/L HNO3
mol/L HNO3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北定州中学高一承智班12月月考化学卷(解析版) 题型:选择题
下列离子方程式正确的是
A.碳酸氢钠与醋酸反应:HCO3-+H+=CO2↑+H2O
B.等物质的量的硫酸氢钠与氢氧化钡溶液:SO42-+H++Ba2++OH-=H2O+BaSO4↓
C.氯化铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓
D.金属钠与H 2O
2O 反应:Na+H2O=Na++OH-+H2↑
反应:Na+H2O=Na++OH-+H2↑
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高一上期中化学卷(解析版) 题型:选择题
10月11日早上7点30分,神舟十一号飞船发射成功。其运载火箭点火后,偏二甲肼与四氧化二氮发生剧烈反应:(CH3) 2NH2+2N2O4=2CO2+4H2O+3N2,下述正确的说法是( )
A.该反应既是分解反应又是离子反应 B.N2O4被还原
C .(CH3) 2NH2中碳元索为+4 价 D.H2O是还原产物
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高一上期中化学卷(解析版) 题型:选择题
下列化学反应的离子方程式书写正确的是( )
A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B.金属铜投入硝酸银溶液中:Cu+Ag+=Cu2++Ag
C氢氧化铜固体投入稀硝酸:Cu(OH)2+2H+=Cu2++2H2O
D.石灰石溶于醋酸:CaCO3+2H+=Ca2++H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一12月月考化学卷(解析版) 题型:推断题
根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
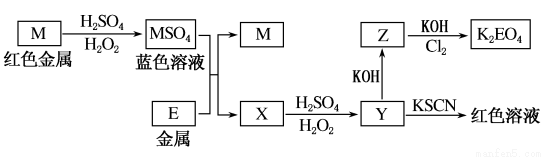
(1)写出M溶于稀H2SO4和H2O2混合液的化学方程式:_____________________________。
(2)某同学取X的溶液,酸化后加入KI淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式:________________,________________。
(3)写出Cl2将Z氧化为K2EO4的化学方程式:____________________。
(4)将M、E、ECl3溶液、ECl2溶液和MCl2溶液混合于某容器中充分反应(容器不参与反应),试判断下列情况下容器中存在的金属离子和金属单质。
①若E有剩余,则容器中不可能有________。
②若MCl2有剩余,则容器中还可能有________,一定有________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一12月月考化学卷(解析版) 题型:选择题
某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3∶2,则样品中铁、铝物质的量之比为( )
A.3∶2 B.2∶1
C.3∶4 D.4∶3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二12月月考化学卷(解析版) 题型:选择题
除去下列物质中的杂质(括号中为杂质),采用的试剂和除杂方法错误的是( )
序号 | 待除杂质 | 试剂 | 除杂方法 |
A | C2H4(SO2) | NaOH溶液 | 洗气 |
B | C6H6(Br2) | Fe粉 | 蒸馏 |
C | C6H5NO2(NO2) | NaOH | 分液 |
D | C2H2(H2S) | CuSO4 | 洗气 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南浏阳一中等两校高二12月联考化学卷(解析版) 题型:实验题
某常用的血液抗凝剂由(NH4)2C2O4和Na2C2O4组成,为确定其成分,某同学进行如下实验:
①氮元素测定:精确称取a g样品,加适量蒸馏水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量浓NaOH溶液,加热装置A产生水蒸气,装置B中产生的氨气全部吹出,用V1mLc1mol/L的硫酸溶液吸收。蒸氨结束后取下接收瓶,用c2mol/LNaOH标准溶液过剩的H2SO4,到终点时消耗V2mLNaOH溶液。
②C2O42-离子的测定:取实验①B装置中剩余溶液于锥形瓶中,先用稀硫酸酸化,再用0.1000mol/L的酸性KMnO4溶液滴定,终点时消耗酸性KMnO4溶液V3mL。
③计算:根据实验①计算氮元素的含量,根据②计算C2O42-的含量,从而得到样品中(NH4)2C2O4和Na2C2O4的比例。完成下列问题:
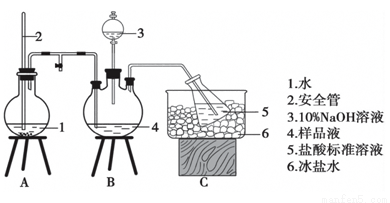
(1)装置A中长玻璃管的作用是 。
(2)用NaOH标准溶液滴定过剩H2SO4时, NaOH标准溶液盛装在 中(填仪器名称)。
(3)样品中氮元素的质量分数表达式为 。
(4)实验②中发生的离子方程式为 。用酸性高锰酸钾溶液滴定时终点现象为 。
(5)实验②中滴定开始和结束时,滴定管的读数如图所示,则所用酸性KMnO4溶液体积V3= mL
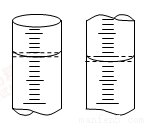
(6)下列操作可能使实验②测定结果偏低的是 。
A.滴定管在注入溶液前用蒸馏水洗后未用标准溶液润洗
B.开始时酸式滴定管尖嘴部分有气泡,滴定过程中消失
C.滴定前仰视滴定管读数,滴定后平视滴定管读数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com