
| 实验步骤 | 预期实验现象 | 预期实验结论 |
分别取30mL 0.5mol?L-1 MgCl2、AlCl3溶液于烧杯中,充分混合 分别取30mL 0.5mol?L-1 MgCl2、AlCl3溶液于烧杯中,充分混合 |
无现象 无现象 |
溶液中水解不能生成沉淀 溶液中水解不能生成沉淀 |
向混合溶液中滴入2滴酚酞试液,逐滴加入1mol?L-1 NaOH溶液 向混合溶液中滴入2滴酚酞试液,逐滴加入1mol?L-1 NaOH溶液 |
当溶液中生成大量的白色絮状沉淀后溶液的颜色不变 当溶液中生成大量的白色絮状沉淀后溶液的颜色不变 |
产生的沉淀可能是氢氧化铝、氢氧化镁或二者的混合物 产生的沉淀可能是氢氧化铝、氢氧化镁或二者的混合物 |
将上述混合溶液过滤,洗涤,再向滤渣中加入过量的1mol?L-1 NaOH溶液 将上述混合溶液过滤,洗涤,再向滤渣中加入过量的1mol?L-1 NaOH溶液 |
滤渣全部溶解 滤渣全部溶解 |
产生的沉淀只有氢氧化铝 产生的沉淀只有氢氧化铝 |
空 空 |
空 空 |
空 空 |
| 实验步骤 | 实验现象 | 实验结论 |
| ①另取0.5mol?L-1 MgCl2、AlCl3溶液各30mL于不同烧杯中 | 溶液中无现象 溶液中无现象 |
水溶液中无氢氧化镁、氢氧化铝沉淀生成 水溶液中无氢氧化镁、氢氧化铝沉淀生成 |
| ②向0.5mol?L-1 AlCl3溶液中逐滴加入NaOH溶液至刚好反应完全 | 产生沉淀,沉淀溶解,沉淀消失 | 产生氢氧化铝沉淀,加过量的氢氧化钠溶液后氢氧化铝又溶解 |
| ③将MgCl2溶液全部倒入②反应后的溶液中 | 产生大量白色沉淀 | 二者混合时相互促进水解最终生成Mg(OH)2和Al(OH)3沉淀. 二者混合时相互促进水解最终生成Mg(OH)2和Al(OH)3沉淀. |
| 实验步骤 | 预期实验现象 | 预期实验结论 |
| ①分别取30mL 0.5mol?L-1 MgCl2、AlCl3溶液于烧杯中,充分混合 | ||
| ②向混合溶液中滴入2滴酚酞试液,逐滴加入1mol?L-1 NaOH溶液 | 当溶液中生成大量的白色絮状沉淀后溶液的颜色不变 | 产生的沉淀可能是氢氧化铝、氢氧化镁或二者的混合物 |
| ③将上述混合溶液过滤,洗涤,再向滤渣中加入过量的1mol?L-1 NaOH溶液 | 滤渣全部溶解 | 产生的沉淀只有氢氧化铝 |
| 实验步骤 | 预期实验现象 | 预期实验结论 |
| ①分别取30mL 0.5mol?L-1 MgCl2、AlCl3溶液于烧杯中,充分混合 | ||
| ②向混合溶液中滴入2滴酚酞试液,逐滴加入1mol?L-1 NaOH溶液 | 当溶液中生成大量的白色絮状沉淀后溶液的颜色不变 | 产生的沉淀可能是氢氧化铝、氢氧化镁或二者的混合物 |
| ③将上述混合溶液过滤,洗涤,再向滤渣中加入过量的1mol?L-1 NaOH溶液 | 滤渣全部溶解 | 产生的沉淀只有氢氧化铝 |


科目:高中化学 来源: 题型:阅读理解
| ①镁、铝、锌都是银白色的金属 ②锌(Zn)可以与NaOH溶液反应生成H2 ③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3?H2O ④Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+●提出假设: (1)假设①:该混合金属粉末中除镁外还含有 Al Al 元素假设②:该混合金属粉末中除镁外还含有 Zn Zn 元素假设③:该混合金属粉末中除镁外还含有铝、锌元素 ●实验探究: 甲同学基于假设③设计实验方案如下:乙同学同样基于假设③设计另一实验方案如下: 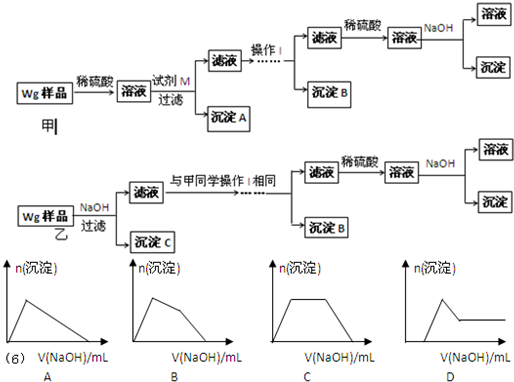 (2)试剂M是 NaOH溶液 NaOH溶液 ;沉淀B是Al(OH)3 Al(OH)3 .(3)丙同学认为乙同学的方案比甲同学的好,理由是 步骤简单,节约试剂 步骤简单,节约试剂 .(4)丁同学研究了甲、乙两同学的方案后,在其中一种方案的基础上用最简便方法测定了Wg样品中金属镁(Mg)的质量,他的方法是 将沉淀C洗涤、小心干燥后称量 将沉淀C洗涤、小心干燥后称量 .(5)操作Ⅰ的主要过程是:在滤液中逐滴加入 稀硫酸 稀硫酸 ,直至生成的沉淀刚好溶解,再加入足量的稀氨水 稀氨水 .(6)某溶液中含有Zn2+、Al3+、NH4+和SO42-等离子,向其中逐滴加入NaOH溶液,则生成沉淀的物质的量与加入NaOH溶液体积关系的图象正确的是 B B .
查看答案和解析>> 科目:高中化学 来源: 题型: 某研究小组探究MgCl2和AlCl3溶液加入氢氧化钠溶液生成沉淀及沉淀溶解的情况,实验过程中可能用到的仪器与药品如下: 过滤装置,试管,烧杯,滴管,0.5mol/L MgCl2、AlCl3各100mL,酚酞溶液,石蕊溶液,0.1mol/L NaOH溶液,6mol/L NaOH溶液,0.1mol/L盐酸 探究一:实验开始时产生沉淀的成份 [假设一]实验开始时产生的沉淀是Mg(OH)2 [假设二] [假设三]实验开始时产生的沉淀是Al(OH)3和Mg(OH)2 基于假设二成立,请利用下表完成实验过程:
由探究实验一、二分析可知,当向相同浓度的MgCl2、AlCl3混合溶液中滴加氢氧化钠溶液时产生沉淀及沉淀溶解的顺序是 查看答案和解析>> 科目:高中化学 来源: 题型:阅读理解 我国有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。镁因其合金性能卓越,在汽车、飞机制造方面很重要,有“国防金属”之称。发达国家多数从海洋中提镁,中国海水提镁技术也在不断进步。海水中虽含镁离子很多,但它是很分散的(1.28 g?L-1),要提取镁首先应让镁离子与其它离子等分离。 请回答下列问题: (1)某化学兴趣小组利用煅烧海边贝壳所得产物,投入浓缩的海水中,最终变成了Mg(OH)2浊液。请写出最后一步反应的离子方程式: 。 (2)已知,氧化镁熔点2852℃,氯化镁的熔点714℃。无水氯化镁是工业制取镁的原料。试写出实验室蒸发氯化镁溶液制取无水氯化镁必需的实验仪器是 ;某同学对蒸发得到的固体,用酒精喷灯加热却不能熔化,请你试分析原因 (3)火力发电在江苏的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示: ①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因 。
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,使用氧气将其氧化的化学原理是 (任写一个化学方程式或离子方程式)。氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是 。 查看答案和解析>> 科目:高中化学 来源: 题型: (13分)某研究小组探究MgCl2和AlCl3溶液加入氢氧化钠溶液生成沉淀及沉淀溶解的情况,实验过程中可能用到的仪器与药品如下: 过滤装置,试管,烧杯,滴管,0.5mol/L MgCl2、AlCl3各100mL,酚酞溶液,石蕊溶液,0.1mol/L NaOH溶液,6mol/L NaOH溶液,0.1 mol/L盐酸 探究一:实验开始时产生沉淀的成份 【假设一】实验开始时产生的沉淀是Mg(OH)2 【假设二】 【假设三】实验开始时产生的沉淀是Al(OH)3和Mg(OH)2 基于假设二成立,请利用下表完成实验过程: www.ks5.u.com
探究二:何时产生氢氧化镁沉淀
请用离子方程式表示上述实验步骤③的结论 由探究实验一、二分析可知,当向相同浓度的MgCl2、AlCl3混合溶液中滴加氢氧化钠溶液时产生沉淀及沉淀溶解的顺序是 。 查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |