过氧化镁(MgO
2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.
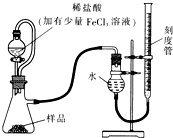
(1)某研究小组拟用如图装置测定一定质量的样品中过氧化镁的含量.
①实验前需进行的操作是
.稀盐酸中加入少量FeCl
3溶液的作用是
.
②用恒压分液漏斗的优点有:使分液漏斗中的溶液顺利滴下;
.
③实验终了时,待恢复至室温,先
,再平视刻度线读数.
(2)实验室还可通过下列两种方案测定样品中过氧化镁的含量:
方案Ⅰ:取a g样品,加入足量稀盐酸,充分反应后再加入 NaOH溶液至Mg
2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g固体.
方案Ⅱ:称取0.1g样品置于碘量瓶中,加入15mL0.6mol/LKI溶液和足量盐酸,摇匀后在暗处静置5min,然后用0.1mol/L Na
2S
2O
3溶液滴定,滴定到终点时共消耗VmL Na
2S
2O
3溶液.(已知:I
2+2Na
2S
2O
3=Na
2S
4O
6+2NaI)
①已知常温下K
sp[Mg(OH)
2]=1×10
-11.为使方案I中Mg
2+完全沉淀[即溶液中c(Mg
2+)≤1×10
-5mol/L],溶液的pH至少应调至
.方案I中过氧化镁的质量分数为
(用含a、b的表达式表示).
②方案Ⅱ中滴定前需加入少量
作指示剂;样品中过氧化镁的质量分数为
(用含V的表达式表示).

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.
过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量.