
【题目】关于下列装置说法正确的是( )
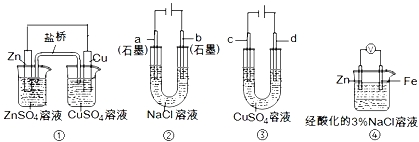
A.装置①中,盐桥中的K+移向ZnSO4溶液
B.装置②工作一段时间后,a极附近溶液的pH增大
C.用装置③精炼铜时,c极为粗铜
D.装置④中电子由Zn流向Fe,装置中有Fe2+生成
【答案】B
【解析】
试题分析:A、在原电池中,电解质中的阳离子移向正极;
B、在电解池的阴极上是阳离子发生得电子的还原反应;
C、电解精炼铜时,电解池的阳极是粗铜;
D、在金属的电化学腐蚀中,电子是从负极流向正极,根据电极反应来判断即可.
解:A、在装置①中,金属锌是负极,金属铜是正极,盐桥中的K+移向CuSO4溶液,故A错误;
B、在电解池装置②的阴极上是阳离子氢离子发生得电子的还原反应,氢离子浓度减小,所以a极附近溶液的pH增大,故B正确;
C、电解精炼铜时,电解池的阳极是粗铜,阴极时精铜,即c极为精铜,故C错误;
D、在金属的电化学腐蚀中,金属锌是负极,金属铁是正极,电子是从负极Zn流向正极Fe,装置中铁电极上会产生氢气,故D错误.
故选:B.


科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法正确的是
A. 燃料的脱硫脱氮、SO2的回收利用和NOX的催化转化都是减少酸雨产生的措施
B. 用FeCl2溶液与铜反应制作印刷电路板
C. 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化
D. 碳酸钠治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知胆矾溶于水时溶液温度降低,室温下将1mol无水硫酸铜制成溶液时放出热量为Q1kJ,又知胆矾分解的热化学方程式为CuSO45H2O(s)═CuSO4(s)+5H2O(l)△H=+Q2kJmol-1则Q1、Q2的关系为
A. Q1<Q2 B. Q1>Q2 C. Q1=Q2 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是( )
A.H2O2的电子式:![]()
B.铝离子的结构示意图:![]()
C.质子数为35、中子数为45的溴原子:![]() Br
Br
D.![]() C与
C与![]() C互为同素异形体
C互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性
Ⅰ.实验室制备FeBr2
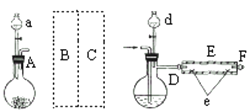
实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管.e是两只耐高温的瓷皿,其中盛有细铁粉.
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁
请回答:
(1)如何检查用塞子(插有导管和仪器)塞紧的D的气密性________.
(2)若在A中盛固体CaCO3,a中盛6mol/L盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为________,C为________.为防止污染空气,实验时应在F处连接盛________的尾气吸收装置
(3)反应过程中要不断通入CO2,其主要作用是①________,②________.
Ⅱ.探究FeBr2的还原性,
(1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是________。
(2)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
设计实验证明假设2是正确的_______________________________
(3)实验证明:还原性Fe2+>Br-请用一个离子方程式来证明:______________________________;
(4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式或化学方程式正确的是
A.粗硅的制取:SiO2+C ![]() Si+CO2↑
Si+CO2↑
B.赤铁矿与稀盐酸的反应:Fe3O4+8H+ = Fe2++2Fe3++4H2O
C.向Ba(OH)2溶液加入过量NaHCO3溶液:2HCO3— + Ba2+ + 2OH— = BaCO3↓+2H2O +CO32-
D.向烧碱溶液中通入氯气可制取漂白粉:Cl2+2NaOH=NaCl+NaClO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应2N2O5(g)═4NO2(g)+O2(g)开始时,c(N2O5)=0.040 8molL﹣1,经1min后,c(N2O5)=0.030 0molL﹣1.则该反应的反应速率为( )
A.v(N2O5)=1.80×10﹣3 molL﹣1min﹣1
B.v(N2O5)=1.08×10﹣2 molL﹣1min﹣1
C.v(NO2)=1.80×10﹣3 molL﹣1min﹣1
D.v(O2)=1.80×10﹣2 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平)
(1)硝酸在该反应中表现出的性质是 .
(2)0.4molCu被硝酸完全溶解后,硝酸得到的电子数是 ,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是 mol.
(3)0.3molCu被另一浓度的硝酸完全溶解后,如果此时产生的NO和NO2气体总体积在标准状况下为8.96L,则被还原的硝酸的物质的量是 mol,参加反应的硝酸的物质的量是 mol,产生的混合气体中NO和NO2体积比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有5种单核粒子,它们分别是4018□、4019□、4019□+、4020□2+、4120□(□内元素符号未写出),则它们所属元素的种类有( )
A. 2种 B. 3种 C. 4种 D. 5种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com