
【题目】如图所示,横轴为溶液的pH,纵轴为Zn2+或ZnO22-物质的量浓度的对数。回答下列问题:
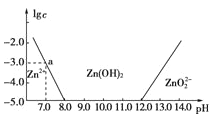
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为__________。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=________________。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液pH的范围是________。
【答案】(1)Zn2++4OH-==ZnO22-+2H2O (2)10-17 (3)8.0~12.0
【解析】
试题分析:(1)由图像可知溶液的碱性较强时,锌的存在形式为ZnO22-,所以其反应的离子方程式为Zn2++4OH-===ZnO22-+2H2O,
(2)当溶液的pH=7.0时,c(Zn2+)=10-3molL-1,Ksp = c(Zn2+) · c2(OH-) = 10-3 (10-7)2=10-17;
(3)根据图像知,溶液的pH范围为8<pH<12时,可将Zn2+转化为Zn(OH)2沉淀,溶液中锌离子浓度小于10-5 molL-1,可以近似认为锌离子不存在;所以为提取Zn2+离子可以控制溶液中pH值的范围是8.0<pH<12.0。


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】各电子层排布电子的总数遵循以下规则:①每层最多容纳2n2个电子;②原子最外层电子数≤8;③原子次外层电子数≤18。决定这3条规律的电子排布规则是( )。
A. 能量最低原则
B. 泡利不相容原理
C. 洪特规则
D. 能量最低原则和泡利不相容原理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用 X 射线对 BaSO4 穿透能力较差的特性,医学上在进行消化系统的 X 射线透视时,常用 BaSO4 作内服造影剂,这种检查手段称为钡餐透视.
(1)医学上进行钡餐透视时为什么不用 BaCO3?(用离子方程式表示)________________________________
(2)某课外活动小组为了探究 BaSO4 的溶解度,分别将足量 BaSO4 放入a.5mL 水 ;b.40mL 0.2molL-1Ba(OH)2 溶 液 c.20mL 0.5molL-1Na2SO4 溶 液 d.40mL 0.1molL-1H2SO4溶液中,溶解至饱和。
①以上各溶液中,Ba2+的浓度由大到小的顺序为_______________________________
A.b>a>c>d B.b>a>d>c C.a>d>c>b D.a>b>d>c
②已知 25℃时,Kap=1.1×10-10,上述条件下,溶液 b 中的 SO42-浓度为_________________molL-1,溶解 c中 Ba2+的浓度为_________________molL-1
③某同学取同体积的溶液 b 和溶液 d④直接混合,则混合液的 pH 为_________________(设混合溶液的体积为混合前两溶液的体积之和)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代传感信息技术在化学实验中有广泛的应用。某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(如图1 所示),并测定电离平衡常数Kb。

(1)实验室制取氨气的化学方程式为_____________;
图1 中用浓氨水和X 固体快速制取NH3,X固体不可以是________(填序号)
A.生石灰 B.无水氯化钙 C.烧碱 D.碱石灰
(2)关闭a,将带有装满水的胶头滴管的橡皮塞塞紧c 口,_______(填操作)可引发喷泉实验,电脑绘制三颈瓶内气压变化曲线如图2 所示。图2中________点时喷泉喷的最剧烈。
(3)喷泉实验结束后,发现水未充满三颈烧瓶(大约占体积的90 % ) ,如装置的气密性良好,烧瓶未充满水的原因是________________,所得氨水的物质的量浓度为________。
(4)从三颈瓶中用__________(填仪器名称)量取25. 00 mL氨水至锥形瓶中,用0.0500mol/LHCl 滴定测定氨水的浓度。用pH 计采集数据、电脑绘制滴定曲线如图3 所示。

当pH=11.0时,NH3·H2O电离平衡常数Kb的近似值,Kb≈_________。
(5)关于该滴定实验的说法中,正确的是_______(填序号)
A. 锥形瓶中有少量蒸馏水不影响测定结果
B.选择酚酞作为指示剂,测定结果偏高
C.酸式滴定管未用盐酸润洗会导致测定结果偏低
D.滴定终点时俯视读数会导致测定结果偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶无色澄清的溶液,可能由以下离子中的几种组成:Na+、K+、NH4+、Fe2+、SO42-、I-、CO32-、Cl-、SO32-、MnO4-,请根据以下实验步骤及现象回答问题:
步骤一:取适量待测液,加入NaOH溶液并加热,得到溶液A,并产生刺激性气味的气体
步骤二:向溶液A加入足量稀盐酸和BaCl2溶液,得到溶液B、白色沉淀和有刺激性气味的气体
步骤三:往B溶液中通入适量Cl2,得到黄褐色溶液C
(1)下列有关该溶液说法正确的是__________。
A. 一定存在SO42-、I-、NH4+、SO32-
B. 一定不存在Fe2+、CO32-、MnO4-
C. 可能存在CO32-、Cl-、Na+、K+
D. 可用AgNO3溶液确认原溶液中是否存在Cl-
(2)步骤三得到黄褐色溶液的离子方程式是____________。
(3)若向原溶液中先加入足量的盐酸,再加入足量的________(填化学式)并加热,通过现象也能得出步骤一、二相同的结论。
(4)对于溶液中还可能存在的阳离子,确认其存在的实验方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝箔在空气中加热,金属熔化而不滴落的原因是( )
A.熔化的金属铝非常黏稠
B.铝的密度小,所受重力也小
C.大部分铝已经被氧化
D.氧化膜的熔点比铝高,兜住了熔化的铝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com