
【题目】硫铁矿烧渣是一种重要的化工生产中间产物,主要成分是Fe3O4、Fe2O3、FeO和二氧化硅等.下面是以硫铁矿烧渣制备高效净水剂聚合硫酸铁的流程图:
(1)实验室实现“操作I”所用的玻璃仪器有、和烧杯.
(2)检验“酸溶”后的溶液中含有Fe2+试剂是 , 现象是 .
(3)“操作III”系列操作名称依次为、、过滤和洗涤.洗涤的方法是 .
(4)加入适量H2O2的目的是氧化Fe2+ , 写出H2O2氧化Fe2+为Fe3+的离子方程式: .
【答案】
(1)漏斗;玻璃棒
(2)KMnO4溶液;紫红色褪去
(3)蒸发浓缩(加热浓缩);冷却结晶;向漏斗里加入蒸馏水,使水没过沉淀物,等水自然流完后,重复操作2~3次
(4)2Fe2++H2O2+2H+=2Fe3++2H2O
【解析】解:硫铁矿烧渣(主要成分是Fe3O4、Fe2O3、FeO和二氧化硅),加硫酸加热酸溶,水浸,过滤出不溶于酸的二氧化硅,滤液中含有硫酸铁和硫酸亚铁,加废铁皮,Fe与三价铁离子反应生成亚铁离子,过滤去除多余的铁,滤液为硫酸亚铁溶液,然后蒸发浓缩、冷却结晶,得到硫酸亚铁晶体,晶体中加稀硫酸、双氧水得到聚合硫酸铁[Fe2(OH)n(SO4)3﹣n/2]m , (l)根据流程图可知,操作I为过滤,需要的玻璃仪器有漏斗、玻璃棒、烧杯,所以答案是:漏斗、玻璃棒;(2)“酸溶”后的溶液中含有Fe3+和Fe2+ , Fe2+具有还原性,所以检验Fe2+试剂是KMnO4 溶液,现象是紫红色褪去,所以答案是:KMnO4 溶液;紫红色褪去;(3)操作Ⅲ的目的是由溶液得到晶体FeSO47H2O,需蒸发浓缩、冷却结晶,洗涤的操作方法是向漏斗里加入蒸馏水,使水面没过沉淀物,等水自然流完后,重复操作2﹣3次,所以答案是:蒸发浓缩(加热浓缩)、冷却结晶;向漏斗里加入蒸馏水,使水没过沉淀物,等水自然流完后,重复操作2~3次;(4)酸性条件下H2O2氧化Fe2+为Fe3+ , 同时生成水,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,所以答案是:2Fe2++H2O2+2H+=2Fe3++2H2O.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:
【题目】如图是元素周期表中短周期的一部分,X、Y、Z、W四种元素的原子核外最外层电子数之和等于Y、Z元素的原子序数之和,则Z、W的原子序数之和等于( )
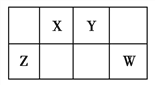
A. 27 B. 29 C. 31 D. 33
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图1所示. 
根据判断出的元素回答问题:
(1)f在元素周期表的位置是 .
(2)比较d、e常见离子的半径的小(用化学式表示,下同)>;比较g、h的最高价氧化物对应的水化物的酸性强弱是:> .
(3)任选上述元素组成一种四原子共价化合物,写出其电子式 .
(4)已知1mol 单质e在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式: .
(5)上述元素可组成盐R:zx4f(gd4)2 , 向盛有10mL1molL1R溶液的烧杯中滴加1molL1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图2如下: 
①写出m点反应的离子方程式 .
②若R溶液改加20mL1.2molL1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中可进行反应A+B![]() C+D,其中A、B在一定条件下反应并测定反应中生成物C的浓度随反应时间的变化情况,绘制出如图所示的图线。(0~t1、t1~t2、t2~t3各时间段相同)下列说法不正确的是
C+D,其中A、B在一定条件下反应并测定反应中生成物C的浓度随反应时间的变化情况,绘制出如图所示的图线。(0~t1、t1~t2、t2~t3各时间段相同)下列说法不正确的是

A. 该反应是吸热反应
B. 反应速率最大的时间段是在t1~t2
C. 四个时间段内生成C的量最多的是t1~t2
D. 反应速率后来减慢主要是受反应物浓度变化的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知有1H216O、2H2S、3H218O、3H2S、S16O2,这些分子中含有____种核素。画出18O2-的离子结构示意图:__________。
(2)下列过程中,共价键被破坏的是________。能表示反应物的总能量高于生成物总能量的化学反应是___________。
①碘升华 ②氢气在氧气中燃烧 ③HCl 气体溶于水 ④酒精溶于水
⑤冰融化 ⑥氢氧化钠熔化 ⑦NH4Cl受热分解 ⑧(NH4)2SO4溶于水
(3)根据元素周期表和元素周期律分析下面的推断,其中错误的是_______。
①砹(At)的氢化物不稳定 ②硒(Se)化氢比硫化氢稳定
③铍的原子失电了能力比镁弱 ④氢氧化铝比氢氧化钙的碱性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2是常用的绿色氧化剂,H2S是还原剂,但H2S会对环境和人体健康带来极大危害。
I.H2S的除去,生物脱H2S的原理为:H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4、4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3+2H2O。
2Fe2(SO4)3+2H2O。
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是_____。
(2)由图甲和图乙判断他用硫杆菌的最佳条件为_______。在最佳条件下,该反应的加热方式为_________,若反应温度过高,反应速率下降,其原因是__________。

II.为研究硫酸饮的量对过氧化氢分解速率的影响,某同学设计了如下一系列的实验。将表中所给的溶液分别加入A、B、C、D四个反应瓶中,收集产生的气体,在关数据如下:
实验溶液 | A/mL | B/mL | C/mL | D/mL |
0.4mol/LFe2(SO4)3溶液 | 0 | 1.0 | 2.0 | V1 |
30%H2O2溶液 | V2 | 20.0 | 20.0 | 20.0 |
H2O | 18.0 | 17.0 | V3 | 15.0 |
(1)实验过程中需记录的数据是___________。
(2)上表中的V2=_______,V3=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2 ![]() 2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是( ) ①单位时间内生成n mol O2的同时生成2n mol NO2
2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是( ) ①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态.
A.①④⑥⑦
B.②③⑤⑦
C.①③④⑤
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置制取NH3,并用AlCl3溶液吸收多余NH3制Al(OH)3,最后回收NH4Cl,能达到实验目的的是

A. 用装置甲制取NH3
B. 用装置乙吸收NH3制取Al(OH)3
C. 用装置丙分离Al(OH)3和NH4Cl溶液时,用玻璃棒不停的在漏斗内搅拌
D. 用装置丁蒸干NH4Cl溶液并灼烧制NH4Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com