
| A.υ(A)=0.5mol?L-1?min-1 | B.υ(B)=0.2mol?L-1?min-1 |
| C.υ(C)=0.015mol?L-1?s-1 | D.υ(D)=1mol?L-1?min-1 |
| v(A) |
| 2 |
| 0.5mol?L-1?min-1 |
| 2 |
| v(B) |
| 1 |
| v(C) |
| 3 |
| v(D) |
| 4 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
 2NH3)的反应速率,其中速率代表同一反应的是( )
2NH3)的反应速率,其中速率代表同一反应的是( )| A.①② | B.①③ | C.③④ | D.②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.① | B.② | C.③ | D.④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应速率是指一定时间内,任何一种反应物浓度的减少或任何一种生成物浓度的增加 |
| B.根据化学反应速率的大小可以知道化学反应进行的快慢 |
| C.化学反应速率为0.8mol.L-1.S-1,是指1s时,物质的量浓度为0.8mol.L_1 |
| D.对任何化学反应来说,反应速率越大化学现象越明显 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 编号 | 温度/℃ | 加入某盐 | H2SO4体积/mL | H2O体积/mL | 铝粉加入量/g | 铝粉溶解量 /g |
| ① | 20 | 不加 | 40 | 0 | 2.0050 | 0.0307 |
| ② | 80 | 不加 | 40 | 0 | 2.0050 | 0.1184 |
| ③ | t1 | 不加 | 20 | V1 | 2.0050 | ﹨ |
| ④ | t2 | 5 mL0.01 mol·L-1 CuSO4溶液 | 20 | V2 | 2.0050 | ﹨ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验 序号 | 碳酸钙状态 | c(HCl)/mol·L-1 | 溶液温度/oC | 碳酸钙消失时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 粒状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 粒状 | 0.6 | 20 | 41 | 280 |
| 4 | 粒状 | 0.8 | 20 | 40 | 200 |
| 5 | 粉末 | 0.8 | 20 | 40 | 30 |
| 6 | 粒状 | 1.0 | 20 | 40 | 120 |
| 7 | 粒状 | 1.0 | 30 | 50 | 40 |
| 8 | 粒状 | 1.2 | 20 | 40 | 90 |
| 9 | 粒状 | 1.2 | 25 | 45 | 40 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2B(g)+C(g)ΔH<0,在未用催化剂的条件下已达平衡,现要使正反应速率降低,c(B)减小,应采取的措施是
2B(g)+C(g)ΔH<0,在未用催化剂的条件下已达平衡,现要使正反应速率降低,c(B)减小,应采取的措施是查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g) △H<0,n(NH3)和n(H2)随时间(t)的变化关系如右图所示。下列分析一定正确的是
2NH3(g) △H<0,n(NH3)和n(H2)随时间(t)的变化关系如右图所示。下列分析一定正确的是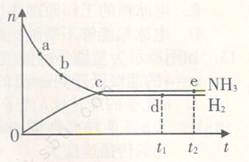
| A.正反应速率:a点小于b点 |
| B.c点处反应达到平衡 |
| C.d点和e点处的n(N2)不一样 |
| D.若其他条件不变,在773 K时反应至t1时刻,n(H2)比图中d点对应的n(H2)大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com