
����Ŀ�������ж�����̼�����ij������ӣ����������ЧӦ��һ�ִ���������̼����Ҫ�����ǽ�������̼��ԭ��![]() ������˵��(NA���������ӵ�����)��ȷ����
������˵��(NA���������ӵ�����)��ȷ����
A. 2.24LCO2����˫������ĿΪ0.2NA
B. 1molCO2��2molH2��ַ�Ӧ����CH4������Ϊ0.5NA
C. ͨ��״���£�0.1molCH4�к��еĵ�����ΪNA
D. ����18gH2Oת�Ƶ�����Ϊ8NA
���𰸡�C
��������A�û��ָ�����ڱ�״���£���A����B��÷�ӦΪ���淴Ӧ�����淴Ӧ���ܽ��е��ף�1molCO2��2molH2��ַ�Ӧ��������0.5mol CH4����CH4������С��0.5NA����B������C��������1��CH4�к��е�10�����ӣ�1molCH4�к��е�10mol����,��0.1molCH4�к��еĵ�����ΪNA���������أ���C��ȷ��D����������ѧ����ʽ֪��![]() ��ÿ����2molˮת��8mol���ӣ�������18gH2O��1molˮ����ת�Ƶ�����Ϊ4NA����Dѡ������ۺ����Ϸ�����������ȷ��ΪC��
��ÿ����2molˮת��8mol���ӣ�������18gH2O��1molˮ����ת�Ƶ�����Ϊ4NA����Dѡ������ۺ����Ϸ�����������ȷ��ΪC��


 �����ܿ����ϵ�д�
�����ܿ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH4Al(SO4)2��ʳƷ��ҽҩ�����ӹ�ҵ����;�㷺���ش���������:
(1)NH4Al(SO4)2������ˮ������������____________________(�����ӷ���ʽ��ʾ)��
(2)��ͬ�����£�0.1mol/LNH4Al(SO4)2��Һ�У�c(NH4+)_____0.1mol/LNH4HSO4��Һ��c(NH4+)(����ڡ��������ڡ���С�ڡ�)��
(3)��ͼ��0.1mol/L �������Һ��pH ���¶ȱ仯��ͼ��

�����з���0.1mol/LNH4Al(SO4)2��Һ����________(����ĸ)��������ҺpH���¶ȱ仯��ԭ����_____________________________��
��20��ʱ��0.1mol/LNH4Al(SO4)2��Һ�У�2c(SO42-)-c(NH4+) -3c(Al3+)=_____mol/L��
(4)����ʱ����0.1mol/LNH4Al(SO4)2��Һ�еμ�0.1mol/LNaOH ��Һ���õ���ҺpH��NaOH��Һ�����ϵ������ͼ��ʾ:
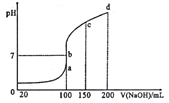
����֪:Ksp[Al(OH)3]=1��10-33��Al3+������ȫʱ(ʹ��Ũ��С��1��10��6mol��L��1)����Һ��pH=_______���Է���ͼ��a��b��c��d�ĵ㣬ˮ�ĵ���̶�������______________________��
����b�㣬��Һ�и�����Ũ���ɴ�С��˳����_______________��
��b-c������NaOH�ļ��룬��Һ��c(NH3��H2O)/c(OH-)��ֵ_____(���������С���� �����䡱)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ĸ�ͼ������ӳ����������Ӧ��Ӧ���ϵ���(a��b��c��d������0)�� ��
A. 4NH3(g)��5O2(g)![]() 4NO(g)��6H2O(g)��H��-akJ��mol-1
4NO(g)��6H2O(g)��H��-akJ��mol-1
B. N2(g)��3H2(g)![]() 2NH3(g)��H��-bkJ��mol-1
2NH3(g)��H��-bkJ��mol-1
C. 2SO3(g)![]() 2SO2(g)��O2(g)��H��+ckJ��mol-1
2SO2(g)��O2(g)��H��+ckJ��mol-1
D. 2N2O5(g)![]() 4NO2(g)��O2(g)��H��+dkJ��mol-1
4NO2(g)��O2(g)��H��+dkJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z��W��Ϊ��ѧ��ѧ�г����ĵ��ʻ������֮���ת����ϵ��ͼ��ʾ(���ֲ�������ȥ)����W��X��������
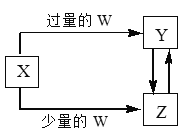
ѡ�� | W | X |
A | ���� | ̼������Һ |
B | ����������Һ | �Ȼ�����Һ |
C | ������̼ | ����������Һ |
D | ���� | ������ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����þ���仯�����ڹ�ũҵ������Ӧ�ù㷺����֪����þ����Ҫ�ɷ�ΪMg2B2O5H2O����ɰ�Ļ�ѧʽΪNa2B4O710H2O��������þ����ȡ����þ������Ĺ����������£���ش������й����⣺
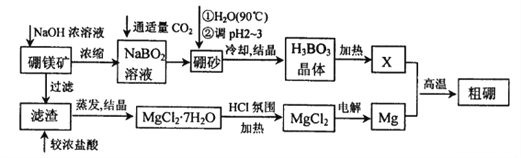
��1����ɰ��B�Ļ��ϼ�Ϊ_________����������Ҫ�ɷ�Ϊ_______________��
��2��XΪH3BO3���������ˮ�IJ������Mg��ȡ����Ļ�ѧ����ʽΪ_________________________��
��3��H3BO3��һ��һԪ���ᣬҲ��д��B(OH)3������ˮ����ʱ���ˮ�����OH-�������ԣ���һ�仯�����ӷ���ʽΪ______________________________��
��4��MgCl2��6H2O��Ҫ��HCl��Χ�м��ȣ���Ŀ����______________________��
��5����֪25��ʱ��Ksp[Mg(OH)2]=5.6��10-12�����ָʾ�����������ɫ��pH��Χ���£�
pH | ��8.0 | 8.0��9.6 | ��9.6 |
��ɫ | ��ɫ | ��ɫ | ��ɫ |
��Mg(OH)2������Һ�еμ�2�ΰ������ָʾ������Һ����ɫΪ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ij���������ȡ���ռ���β������װ����ͼ��ʾ��ʡ�Լгֺ;���װ��)�����ô�װ�úͱ����ṩ������������ʵ�飬�������ѡ����
ѡ�� | a�е����� | b�е����� | c���ռ������� | d�е����� |
|
A | Ũ��ˮ | CaO | NH3 | H2O | |
B | Ũ���� | Na2SO3 | SO2 | NaOH��Һ | |
C | ϡ���� | Cu | NO2 | H2O | |
D | Ũ���� | ľ̿ | CO2 | NaOH��Һ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����û�ѧԭ�����ԶԹ����ŷŵķ�ˮ�������Ƚ�����Ч��������������ij�������Ƹ﹤ҵ�����в��Ĵ���������������:
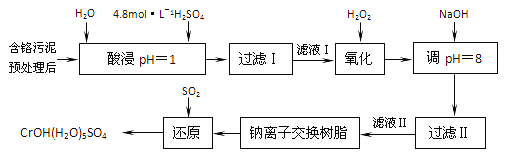
��֪�����ȡҺ�еĽ���������Ҫ��Cr3+�������Fe3+��Al3+��Ca2+��Mg2+��
��1�� ���ʱ��Ϊ����߽�ȡ�ʿɲ�ȡ�Ĵ�ʩ��_________��___________��(�������)��
��2��H2O2�������ǽ���ҺI�е�Cr3+ת��ΪCr2O72-����˷�Ӧ���������ͻ�ԭ�����ʵ���֮��Ϊ_______��
��3�������£�����������������������ʽ����ʱ��Һ��pH���£�
������ | Fe3+ | Al3+ | Cr3+ |
��ʼ����ʱ��pH | 2.7 | �� | �� |
������ȫʱ��pH | 3.7 | 5.4(>8�ܽ�) | 9(>9�ܽ�) |
����NaOH������Һ��pH���ܳ���8����������________________��
����pH=8ʱ��Mg2+�Ƿ�ʼ����(��Һ��þ����Ũ�Ȳ�����1mol��L-1)��____(����������������(��֪Ksp[Mg(OH)2]=1.8��10-11)��
��4�����������У�����NaOH��Һ����Һ�ʼ��ԣ�Cr2O72-ת��ΪCrO42-��д��������������SO2���л�ԭʱ������Ӧ�����ӷ���ʽ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʾ��ÿ����в�����ʵ��ǣ�������
A.������ˮ
B.Ư��
C.�������Ʒ�ĩ
D.�Ȼ��ƹ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʯ�Ͳ�Ʒ�к���H2S��COS��CH3SH�ȶ����л�����ʯ�ͻ�����������������������ش�����������
��1��COS�ĵ���ʽ��_______________��
��2����֪�Ȼ�ѧ����ʽ����2H2S(g)+SO2(g)=3S(s)+2H2O(l) ��H=-362kJ��mol-1
��2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ��H2=-1172kJ��mol-1
��H2S�����������Ӧ���ɹ�̬���Һ̬ˮ���Ȼ�ѧ����ʽΪ__________________��
��3��������K2CO3��Һ����H2S����ԭ��ΪK2CO3+H2S=KHS+KHCO3���÷�Ӧ��ƽ�ⳣ��Ϊ________��(��֪H2CO3��Ka1=4.2��10-7��Ka2=5.6��10-11��H2S��Ka1=5.6��10-8��Ka2=1.2��10-15)
��4����ǿ����Һ����H2O2�ɽ�COS����Ϊ��������һԭ��������COS�����÷�Ӧ��Ӧ�Ļ�ѧ����ʽΪ_________________��
��5��COS��ˮ�ⷴӦΪCOS(g)+H2O(g)![]() CO2(g)+H2S(g) ��H<0��ij�¶�ʱ���û�����-Al2O3���������ں����ܱ�������COS(g)��ƽ��ת�����治ͬͶ�ϱ�[n(H2O)/n(COS)]��ת����ϵ��ͼ1��ʾ������������ͬʱ���ı䷴Ӧ�¶ȣ����һ��ʱ����COS��ˮ��ת������ͼ2��ʾ��
CO2(g)+H2S(g) ��H<0��ij�¶�ʱ���û�����-Al2O3���������ں����ܱ�������COS(g)��ƽ��ת�����治ͬͶ�ϱ�[n(H2O)/n(COS)]��ת����ϵ��ͼ1��ʾ������������ͬʱ���ı䷴Ӧ�¶ȣ����һ��ʱ����COS��ˮ��ת������ͼ2��ʾ��

���÷�Ӧ���������Ϊ:Ͷ�ϱ�[n(H2O)/n(COS)]____���¶�_____________
��P���Ӧ��ƽ�ⳣ��Ϊ_____________��(����С�����2λ)
�����¶����ߵ�һ��ֵ��������һ��ʱ����COS(g)��ˮ��ת���ʽ��ͣ��²���ܵ�ԭ����__________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com