
【题目】50g物质的量浓度为C1的浓H2SO4,质量分数为W1,与体积为V的水混合后得到物质的量浓度为C2的稀H2SO4,质量分数为W2(以下填“>”“<”或“=”)
(1)若W1=2W2,则C1_________2C2,V_________50mL.
(2)若C1=2C2,则W1_________2W2,V_________50mL.
【答案】(1)> = (2)< <
【解析】
试题分析:(1)设物质的量是浓度为c1 molL-1的密度为ρ1,物质的量是浓度为c2molL-1硫酸溶液的密度为ρ2,则c1=![]() ,c2=
,c2=![]() ;所以
;所以![]() ,由于W1=2W2,所以
,由于W1=2W2,所以![]() ,因浓硫酸的密度大于水,溶液的浓度越大,密度越大,则ρ1>ρ2,所以c1>2c2;
,因浓硫酸的密度大于水,溶液的浓度越大,密度越大,则ρ1>ρ2,所以c1>2c2;
设物质的量是浓度为c2molL-1硫酸溶液的质量为m,则
50g×W1=m×W2,所以稀释后硫酸溶液的质量m=![]() g,所以加入水的质量为
g,所以加入水的质量为![]() g-50g,由于W1=2W2,所以加入水的质量为
g-50g,由于W1=2W2,所以加入水的质量为![]() g-50g=50g,所以水的体积V=
g-50g=50g,所以水的体积V=![]() =50ml;
=50ml;
(2)设物质的量是浓度为c1 molL-1的密度为ρ1,物质的量是浓度为c2molL-1硫酸溶液的密度为ρ2,则:由c=![]() 可知,W1=
可知,W1=![]() ,W2=
,W2=![]() ,所以
,所以![]() ,由于C1=2C2,所以
,由于C1=2C2,所以![]() ,因浓硫酸的密度大于水,溶液的浓度越大,密度越大,则ρ1>ρ2,所以W1<2W2;
,因浓硫酸的密度大于水,溶液的浓度越大,密度越大,则ρ1>ρ2,所以W1<2W2;
设物质的量是浓度为c2molL-1硫酸溶液的质量为n,则
50g×W1=n×W2,所以稀释后硫酸溶液的质量n=![]() g,所以加入水的质量为
g,所以加入水的质量为![]() g-50g,由于W1<2W2,所以加入水的质量为
g-50g,由于W1<2W2,所以加入水的质量为![]() g-50g<50g,所以水的体积V<
g-50g<50g,所以水的体积V<![]() =50ml。
=50ml。


科目:高中化学 来源: 题型:
【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为___________,氧化性最弱的简单阳离子是(填离子符号)___________。
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
①工业制镁时,电解MgCl2而不电解MgO的原因是______________;
②制铝时,电解Al2O3而不电解AlCl3的原因是_________________;
③写出电解Al2O3反应方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型纳米材料氧缺位铁酸盐(MFe2Ox)(3<x<4,M表示Mn、Co、Zn或Ni的二价离子),常温下,它能使工业废气中的SO2、NO2等氧化物转化为单质。转化流程如图所示:有关上述转化过程的下列叙述正确的是( )
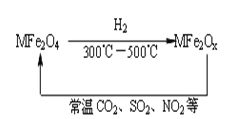
A. MFe2O4表现了还原性
B. MFe2Ox表现了还原性
C. SO2和NO2表现了还原性
D. SO2和NO2发生了分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中的实验操作能达到实验目的或能得出相应结论的是( )
选项 | 实验操作 | 实验目的或结论 |
A | 向含有少量FeCl3的MgCl2溶液中加入足量NaOH溶液,搅拌后静置过滤 | 除去MgCl2溶液中少量FeCl3 |
B |
| NaHCO3比Na2CO3受热更易分解 |
C |
| 制取并收集氨气 |
D | 将混有Ca(OH)2杂质的Mg(OH)2样品,放入水中搅拌成浆状后,加入足量饱和氯化镁溶液充分搅拌、过滤,沉淀用蒸馏水洗涤 | 除去Mg(OH)2样品中的Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中满足上述关系的元素共有
A. 1对 B. 2对 C. 3对 D. 4对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.工业上用石灰乳制备漂白粉:Ca(OH)2+Cl2=Ca2++ClO-+Cl-+H2O
B.向硫酸铝铵溶液中滴加少量Ba(OH)2溶液:NH+Al3++2SO+2Ba2++5OH-=AlO+2BaSO4↓+NH3·H2O+2H2O
C.制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里从海藻中提取碘的流程图如下:

(1)指出制取碘的过程中有关的实验操作名称:
①________________,②____________________。
(2)灼烧海藻时,除需要三脚架外,还需要用到的仪器是 (从下列仪器中选择所需的仪器,将标号字母填写在空白处)。
A烧杯 B坩埚 C表面皿 D泥三角 E酒精灯 F干燥器
(3)提取碘的过程中,可供选择的有机溶剂是_____ ___(填字母序号)。(乙酸、甘油均可溶于水)
A.甲苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、甘油
(4)进行上述蒸馏操作时,最后晶体碘在 里聚集。
(5)含碘的有机物溶液中提取碘和回收有机溶剂,还需要经过蒸馏,观察下列实验装置,指出有其错误
有 处。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯(C7H8)和甘油(C3H8O3)组成的混合物中,若碳元素的质量分数为60%,那么可以推断氢元素的质量分数约为
A.5% B.8.7% C.17.4% D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A.Cu溶于稀HNO3:Cu+2 H++NO![]() ===Cu2++NO2↑+H2O
===Cu2++NO2↑+H2O
B.用石墨电极电解饱和食盐水:2 Cl-+2 H2O ![]() 2 OH-+H2↑+Cl2↑
2 OH-+H2↑+Cl2↑
C.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-===Fe(OH)2↓
D.向Fe(NO3)3溶液中加入过量的HI溶液:2 Fe3++2 I-===2 Fe2++I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com